黑龙江高三化学月考测验(2019年上册)带答案与解析
| 1. 选择题 | 详细信息 |
|
下列说法错误的是( ) A. 碳酸钠可用于去除餐具的油污 B. 氢氧化铝可用于中和胃酸过多 C. 二氧化硅可用作计算机芯片 D. 铝合金大量用于高铁建设 |
|
| 2. 选择题 | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列说法正确的是( ) A.1mol白磷(P4)中含有的共价键数目是4NA B.2.24L(标况下)Cl2与足量的NaOH溶液反应生成NaCl和NaClO,转移电子数为0.1NA C.常温常压下,14g由C2H4与CO组成的混合气体含有的原子数为NA D.25℃时,1LpH=10的NaHCO3溶液中含有的氢离子数为1×10-4NA |
|
| 3. 选择题 | 详细信息 |
|
食盐在不同分散剂中形成不同分散系。 分散系1:食盐分散在水中形成无色透明溶液 分散系2:食盐分散在乙醇中形成无色透明胶体 下列说法正确的是 A. 分散系1中只有两种离子 B. 分散系2为电解质 C. 可用丁达尔效应区分两个分散系 D. 两个分散系中分散质粒子直径相同 |
|
| 4. 选择题 | 详细信息 |
|
下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是( ) A.将少量CO2通入澄清石灰水溶液中,再通入过量Cl2 B.将少量AgNO3溶液滴加到NaCl溶液中,再滴加Na2S溶液 C.将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液 D.将少量Ba(OH)2溶液滴加到Al2(SO4)3溶液中,再加入过量NaOH溶液 |
|
| 5. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是( ) A.无色透明溶液中:K+、MnO4-、Cl-、H+ B. C.含Na2SO3的溶液中:K+、H+、Cl-、NO3- D.pH=12的无色溶液:K+、Na+、CH3COO-、Br- |
|
| 6. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是( ) A.少量碳酸氢钠溶液逐滴加入到氢氧化钙溶液中: B.在溴化亚铁溶液中通入过量的氯气: C.在NaHSO4溶液中滴入Ba(OH)2溶液至中性: D.少量二氧化硫通入漂白粉溶液中: |
|
| 7. 选择题 | 详细信息 |
|
下列相关实验的说法正确的是( ) A. 称取4.0g固体NaOH,于250mL容量瓶中溶解定容,可制得0.4000mol/L的NaOH溶液 B. 向废铁屑溶于浓盐酸所得溶液中加入酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+ C. 将铂丝用硫酸洗净后,在外焰上灼烧至火焰颜色与酒精灯火焰一致,再蘸取碳酸钾灼烧,直接可观察到火焰呈紫色 D. 向NaAlO2中滴入NaHCO3溶液可析出氢氧化铝沉淀,说明AlO2-结合质子的能力比CO32-强 |
|
| 8. 选择题 | 详细信息 |
|
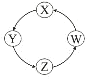
短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( ) A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 B.元素X与氢形成的原子比为1:1的化合物有很多种 C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 D.元素Z可与元素X形成共价化合物XZ2 |
|
| 9. 选择题 | 详细信息 |
|
自然界中的矿石在一定的条件下可以相互转化,当蓝钒遇到硫铁矿时可转化为辉铜矿,有关反应原理可表示为:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列对该反应的分析不正确的是( ) A.CuSO4是氧化剂,Cu2S是还原产物 B.反应中共有2种元素化合价发生变化 C.被氧化的FeS2与被还原的FeS2物质的量之比为2:1 D.每生成1 mol Cu2S,共转移3 mol电子 |
|
| 10. 选择题 | 详细信息 | |||||||||||||||
根据下列实验内容得出的解释和结论都正确的是( )
|
||||||||||||||||
| 11. 选择题 | 详细信息 |
|
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl−、CO32−、SO42−,现取三份各100mL溶液进行如下实验: ①第一份加入AgNO3溶液有沉淀产生 ②第二份加过量NaOH溶液加热后,只收集到气体0.02mol,最终无沉淀生成,同时得到溶液甲 ③在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g ④第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g 下列说法不正确的是( ) A.原溶液中一定不存在的离子为Fe3+、Mg2+、CO32−、Ba2+ B.c(SO42−)=0.5mol/L C.无法判断原溶液中是否存在Cl− D.无法判断原溶液中是否存在K+ |
|
| 12. 选择题 | 详细信息 | ||||||||||||||||||||||||||
下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
|
|||||||||||||||||||||||||||
| 13. 选择题 | 详细信息 |
|
下列关于有机化学的认识中,正确的是( ) A. B.淀粉和纤维素属于多糖,均可在人体内水解转化为葡萄糖,为人类提供能量 C.分子式为C4H10O且能和金属钠反应的有机物共有三种(不考虑立体异构) D.有机物C4H8ClBr的同分异构体(不含立体异构)有12种 |
|
| 14. 选择题 | 详细信息 |
已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得 下列说法中正确的是( ) A.一分子反应物雷琐苯乙酮含有3个碳碳双键 B.苹果酸的一种缩聚产物是 C.1mol产物伞形酮与足量NaOH溶液反应,最多可消耗2molNaOH D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应 |
|
| 15. 选择题 | 详细信息 |
某反应的反应过程中能量变化如图所示。下列叙述不正确的是( ) A.该反应的能量变化与氯化铵晶体和氢氧化钡晶体反应相同 B.该反应的△H=E1−E2 C.若生成物中某一物质由气态变成液态,则该反应的△H变大 D.加入催化剂可以同时降低E1、E2,但不改变反应的△H |
|
| 16. 选择题 | 详细信息 |
下列图示与对应叙述相符合的是( ) A.图I:反应H2+I2⇌2HI达平衡后,升高温度时反应速率随时间的变化 B.图Ⅱ:反应2SO2+O2⇌2SO3达平衡后,缩小容器体积时各成分的物质的量变化 C.图III:反应N2+3H2⇌2NH3在温度一定的情况下,反应速率与压强的关系 D.图IV:反应CO2(g)+H2(g)⇌CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
|
| 17. 选择题 | 详细信息 |
一定条件下,反应:6H2 + 2CO2  下列说法正确的是 A.该反应的△H > 0 B.达平衡时,v(H2)正 = v(CO2)逆 C.b点对应的平衡常数K值大于c点 D.a点对应的H2的平衡转化率为90 % |
|
| 18. 选择题 | 详细信息 |
|
下列溶液中微粒的物质的量浓度关系正确的是( ) A.0.1mol/L的NaHC2O4溶液中存在:c(Na+) + c(H+)=c(HC2O4−) + c(C2O42-) +c(OH−) B.0.1 mol/L的NaHX溶液pH为4,该溶液中:c(HX−)>c(H2X)>c(X2−)>c(H+)>c(OH−) C.25℃时,pH=8的CH3COONa溶液中,c(CH3COOH)约为10−6 mol/L D.在0.1mol/L的 NaF溶液中:c(HF)>c(F−) |
|
| 19. 选择题 | 详细信息 |
氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是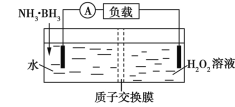 A. 正极的电极反应式为2H++2 B. 电池工作时,H+通过质子交换膜向负极移动 C. 电池工作时,正、负极分别放出H2和NH3 D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子 |
|
| 20. 选择题 | 详细信息 |
25℃时,将浓度均为0.1mol/L。体积分别为 A.a→b过程中水的电离程度始终增大 B. C.b点时,c(B-)=c(A-)=c(OH-)=c(H+) D.由图可知BOH一定是强碱 |
|
| 21. 综合题 | 详细信息 |
|
A、B、C、D、E、F为中学化学常见的单质或化合物,其中A、F为单质,常温下,E的浓溶液能使铁、铝钝化,相互转化关系如图所示(条件已略去)。完成下列问题: (1)若A为淡黄色固体,B为气体,F为非金属单质。 ①写出E转变为C的化学方程式_____。 ②B在空气中能使银器表面失去金属光泽、逐渐变黑,反应的化学方程式为_____。 (2)若B为能使湿润的红色石蕊试纸变蓝的气体。 ①A的电子式为_____。 ②做过银镜反应后的试管可用E的稀溶液清洗,反应的离子方程式为_____。 ③在干燥状态下,向②反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,写出反应的化学方程式_____。  |
|
| 22. | 详细信息 |
醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如图: 相关离子生成氢氧化物的pH和相关物质的溶解性如表:  (1)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的离子方程式___。 (2)滤渣1和滤渣3主要成分的化学式分别是___、____。 (3)写出氧化步骤中加入过氧化氢发生反应的离子方程式______。 (4)调节pH步骤中,溶液pH的调节范围是____。 (5)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)<10-5mol/L],则需要加入碳酸钠固体的物质的量最少为____mol。 |
|
| 23. 综合题 | 详细信息 | ||||||||||||||||||||||||||
|
(1)氨气还原氮氧化物的反应为: ①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2 则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示) 依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。 (2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g) △H<0,测得相关数据如表:
|
|||||||||||||||||||||||||||
| 24. 推断题 | 详细信息 |
M是降低润滑油凝固点的高分子有机化合物,其结构简式为 ,用石油裂解气合成M的路线图如图: ,用石油裂解气合成M的路线图如图: 回答下列问题: (1)B的化学名称为______。 (2)F的分子式为_____。 (3)G中官能团的名称是_____,G与L在一定条件下生成M的反应类型为____。 (4)I→J的反应方程式为_____。 (5)写出2种符合条件的C的同分异构体的结构简式____。(核磁共振氢谱为三组峰,峰面积比为3:2:1;已知双键和羟基相连时物质不稳定) (6)设计由苯乙烯为起始原料制备 |
|