2018-2019年高一第一学期期中考试化学考试(上海市海洋大学附属中学)
| 1. 选择题 | 详细信息 |
|
发现电子的科学家是 A.卢瑟福 B.伦琴 C.道尔顿 D.汤姆孙 |
|
| 2. 选择题 | 详细信息 |
|
美国科学家将两种元素铅和的原子核对撞,获得一种质子数为118,质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为 A.57 B.118 C.175 D.293 |
|
| 3. 选择题 | 详细信息 |
|
易形成简单阴离子的元素是 A.O B.Mg C.Na D.He |
|
| 4. 选择题 | 详细信息 |
|
下列实验室操作类似“海水晒盐”原理的是( ) A. 蒸馏 B. 蒸发 C. 过滤 D. 搅拌 |
|
| 5. 选择题 | 详细信息 |
|
漂粉精中的有效成分是 A. |
|
| 6. 选择题 | 详细信息 |
|
原子核外电子是分层排布的,在不同电子上运动的电子的能量不同,下列电子层上运动的电子能量最高的是 A.K层 B.L层 C.M层 D.N层 |
|
| 7. 选择题 | 详细信息 |
|
下列氯化物中,不能由单质与 A. |
|
| 8. 选择题 | 详细信息 |
|
下列物质中所含分子数目最多的是 A. B.4℃时18mL的 C. D. |
|
| 9. 选择题 | 详细信息 |
|
下表各组变化中,后者一定包括前者的是 A.氧化还原反应;分解反应 B.置换反应;氧化还原反应 C.氧化还原反应;化合反应 D.复分解反应;中和反应 |
|
| 10. 选择题 | 详细信息 |
|
能用NaOH固体干燥的气体是 A.HCl B. |
|
| 11. 选择题 | 详细信息 |
|
潮湿的氯气、新制的氯水及漂粉精的水溶液均能使有色布条褪色,因为它们都含有 A. Cl2 B. HClO C. ClO‾ D. HCl |
|
| 12. 选择题 | 详细信息 |
|
下列关于氧化还原反应的叙述中正确的是( ) A.失去电子的反应为还原反应 B.含有氧元素的物质是氧化剂 C.氧化剂得到电子的数目和还原剂失去的电子的数目一定相等 D.氧化剂和还原剂不可能是同一种物质 |
|
| 13. 选择题 | 详细信息 |
|
我国科学家在兰州成功地制备出过去一直依赖进口、比黄金贵百倍的氧-18气体(又称重氧), A.同种原子 B.同种元素 C.含有相同的质子数 D.同位素 |
|
| 14. 选择题 | 详细信息 |
|
以下不属于氯气用途的 A.消毒杀菌 B.制漂粉精 C.制盐酸 D.制食盐 |
|
| 15. 选择题 | 详细信息 |
|
A.n-2 B.n+2 C.n D.A-n |
|
| 16. 选择题 | 详细信息 |
|
用化学方法区别Cl2和HCl气体,应选用的试剂是 A. |
|
| 17. 选择题 | 详细信息 |
|
下列物质中的S元素只具有还原性的是 A. |
|
| 18. 选择题 | 详细信息 |
|
下列各组微粒中,核外电子排布相同的是 A. C. |
|
| 19. 选择题 | 详细信息 |
|
下列电离方程式错误的是 A.AlCl3=Al3++3Cl- B.NaClO= Na++ Cl-+O2- C. Ba(OH)2=Ba2++2OH- D. H2SO4=2H++SO42- |
|
| 20. 选择题 | 详细信息 |
|
16O中的16的含义是 A.氧元素的相对原子质量 B.氧元素的一种同位素的相对原子质量 C.氧元素的近似相对原子质量 D.氧元素的一种同位素的质量数 |
|
| 21. 选择题 | 详细信息 |
|
某元素离子R2+核外有23个电子,其质量数为55,则原子核内中子数是 A.30 B.55 C.23 D.32 |
|
| 22. 选择题 | 详细信息 |
|
下列变化中,必须加入氧化剂才能发生的是( ) A.SO2→S B.I-→I2 C.SO32-→SO2 D.HCO3-→CO32- |
|
| 23. 选择题 | 详细信息 |
|
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是 A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ C.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO D.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
|
| 24. 选择题 | 详细信息 |
|
为加速漂粉精的消毒作用,最好的方法是 A.用水溶解 B.加入少量稀盐酸 C.干燥后使用 D.加入NaOH溶液 |
|
| 25. 选择题 | 详细信息 |
|
下列关于氯水的叙述正确的是 A.新制氯水可使有色布条褪色 B.新制氯水中只有 C.光照氯水有气泡逸出,该气体是 |
|
| 26. 选择题 | 详细信息 |
|
下列化学语言正确的是 A.镁离子的电子式 C.氧离子的结构示意图 |
|
| 27. 选择题 | 详细信息 |
|
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O ,下列说法不正确的是( ) A. KClO3在反应中得电子 B. ClO2是还原产物 C. H2C2O4在反应中被氧化 D. 1molKClO3参加反应有2mole-转移 |
|
| 28. 选择题 | 详细信息 |
|
A.1:1 B.5:1 C..2.1 D.1:5 |
|
| 29. 选择题 | 详细信息 |
如图,将潮湿的 A.饱和食盐水 B.浓硫酸 C.KI溶液 D.NaOH溶液 |
|
| 30. 填空题 | 详细信息 |
| 工业上常用氯气和氢气燃烧的方法制取氯化氢气体,由于氯气有毒,因此燃烧管的内管应该通入的气体是_______,需要过量的气体是_______,该过量的气体在电解饱和食盐水时产生在_______极,往该极滴加酚酞,看到的现象是___________________________________。 | |
| 31. 推断题 | 详细信息 |
|
有A、B、C、D四种元素,A元素的原子有三个电子层,最外层上有一个电子;B元素负2价阴离子的电子层结构与氩原子相同;C元素的原子核内无中子;D原子核外电子数比A原子核外电子总数多6个。 (1)C与D形成化合物的化学式_______,其在水中的电离方程式为_______。 (2)B离子的电子式_______,A离子的电子式_______。 (3)B原子的结构示意图_______,D离子的结构示意图_______。 |
|
| 32. 计算题 | 详细信息 |
|
铜与浓硝酸反应的方程式为: (1)在该反应中,被还原的元素是_______,氧化产物是_______。 (2)在方程式标出电子转移的方向和数目_______。 (3)若有32g铜参与反应,被还原的硝酸有_______mol。 |
|
| 33. 填空题 | 详细信息 |
| 工业上用_______和_______作为原料来制取漂粉精,反应的化学方程式为_______;粉精长期暴露在空气中,会使其失效,主要化学方程式__________;______________________,故其应_______保存。 | |
| 34. 实验题 | 详细信息 |
某同学在实验室纯盐的流程如下: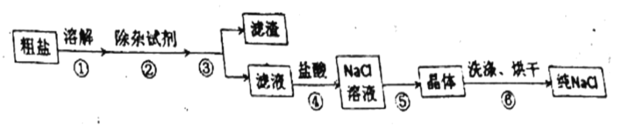 请回答: (1)步骤③、⑤的操作名称是_______、_______。 (2)粗盐中含有 a.②③① b.①②③ c.③②① d.③①② (3)除杂过程中,加入 (4)步骤④判断加入的盐酸“适量”的方法是______________________,步骤⑤加热时要用玻璃棒搅拌,这是为了防止________,加热到_________时,停止加热。 |
|
| 35. 实验题 | 详细信息 |
用纯净干燥的氯气通过如下装置与铁反应。(已知:氯气与铁的产物具有很强的吸湿性,应避免接触潮湿空气。) (1)当纯净干燥的氯气通过灼热铁粉时,可以看到装置A内产生_______,A中发生反应的化学方程式为:_______________。 (2)产物用氯气赶入装置B中冷却收集,推测装置C的作用是_______。 a.吸收多余的氯气 b.吸收空气中的水蒸气 c.吸收空气中的二氧化碳 d.吸收生成的氯化氢 (3)实验前需要用氯气排出装置内原有的空气,请给出一种简易判断装置内已充满氯气的方法__________________________。 |
|
最近更新



