安徽高二化学2020年下册月考测验在线做题
| 1. 选择题 | 详细信息 |
|
化学与生产、生活密切相关,下列对有关事实的说法正确的是 A. 绿色化学的核心是在化学合成中将原子充分利用,转化为新的原子 B. 二氧化硅可作为制造宇宙飞船太阳能电池帆板的主要材料 C. 燃煤中添加适量CaO可减少SO2排放量,燃烧中硫元素转化为CaSO4 D. 生活中常见的金属镁、铝、铁、铜等均能通过热还原法冾炼 |
|
| 2. 选择题 | 详细信息 |
|
化学与社会、生活密切相关,下列说法正确的是 A. 氢氧化铝、碳酸钠常用作胃酸中和剂 B. 蚕丝和人造丝充分水解后均可得到氨基酸 C. 食盐可作调味剂,也可作食品防腐剂 D. 用浓硫酸刻蚀石英材料制作艺术品 |
|
| 3. 选择题 | 详细信息 |
|
下列化合物分子中的所有原子都处于同一平面的是 A. 溴苯 B. 对二甲苯 C. 丙炔 D. 丙烯 |
|
| 4. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值,下列有关叙述正确的是 A.标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA B.1 L 0.1 mol·L−1的NaHCO3溶液中HCO3−和CO32-离子数之和为0.1NA C.常温常压下,NO2与N2O4的混合气体46g,所含氧原子数为2NA D.含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量为56g |
|
| 5. 选择题 | 详细信息 |
|
自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛( A.肉桂醛和苯甲醛都能发生加成反应、取代反应 B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团 C.肉桂醛和苯甲醛互为同系物 D.苯甲醛分子中所有原子可能位于同一平面内 |
|
| 6. 选择题 | 详细信息 | |||||||||||||||
对于下列实验事实的解释,不合理的是
|
||||||||||||||||
| 7. 选择题 | 详细信息 |
下刎有关实验装置、操作,不能实现相应实验目的的是 A. 装置甲可用酸性KMnO4溶液滴定FeSO4溶液 B. 用装置乙进行实验时若逐滴滴加AgNO3溶液先出现黄色沉淀,可说明 Ksp(AgCl)>Ksp(AgI) C. 装置丙可用于收集氢气 D. 装置丁可用于 NaOH溶液除去溴苯中单质溴 |
|
| 8. 选择题 | 详细信息 |
|
分子式为C4H7ClO2的同分异构体甚多,其中能与NaHCO3溶液发生反应产生CO2的同分异构体共有(不考虑立体异构)( ) A. 6种 B. 5种 C. 4种 D. 3种 |
|
| 9. 选择题 | 详细信息 |
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )  A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
|
| 10. 选择题 | 详细信息 |
|
下列解释事实的方程式正确的是 A. 用碳酸氢钠治疗胃酸过多:CO32-+2H+=CO2↑+H2O B. 用氨水吸收烟气中的二氧化硫:SO2+2OH-=SO32-+H2O C. 把金属钠放入冷水中产生气体:Na+2H2O=Na++20H-+H2↑ D. 用氢氧化钠溶液可以溶解氢氧化铝固体:Al(OH)3+OH-=AlO2-+2H2O |
|
| 11. 选择题 | 详细信息 |
|
室温下,关于pH=11的NH3·H2O溶液,下列分析正确的是 A. c(NH3·H2O)=10-3mol/L B. 由水电离出的c(H+)=10-11 mol/L C. 加入少量 NH4Cl固体,NH3·H2O的电离平衡逆向移动,KW值减小 D. 加入等体积 pH=3的盐酸,所得溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
|
| 12. 选择题 | 详细信息 |
|
室温下,甲、乙两烧杯均分别盛有5mLpH=3的盐酸和醋酸溶液,下列描述正确的是( ) A.水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 B.向乙烧杯中加水稀释至pH=4,溶液的体积10V甲>V乙 C.若将甲、乙两烧杯分别与5mLpH=11NaOH溶液反应,所得溶液pH:甲<乙 D.若将甲、乙两烧杯溶液混合,所得溶液中的c(H+)=c(Cl-)+c(CH3COO-) |
|
| 13. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族Y、Z的原子最外层电子数之和等于8,X的简单氢化物与W的简单氢化物反应有大量白烟生成。下列说法正确的是 A. 简单离子半径:Y<Z<W B. Z与W形成化合物的水溶液呈碱性 C. W的某种氧化物可用于杀菌消毒 D. Y分别与X、Z形成的化合物,所含化学键的类型相同 |
|
| 14. 选择题 | 详细信息 |
|
前20号元素X、Y、Z、W、R原子序数依次增大。其中X、Z、R最外层电子数相等,且X与Z、R均可形成离子化合物;Y、W同主族,Y最外层电子数是内层电子数的3倍。下列说法正确的是( ) A.元素原子半径大小顺序为:r(W)> r(Z)> r(Y) B.X分别与Y、Z、W形成的常见化合物都属于电解质 C.Y分别与Z、R形成的化合物中均只含有离子键 D.Y分别与Z、W均可形成具有漂白性的化合物,且漂白原理相同 |
|
| 15. 实验题 | 详细信息 |
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)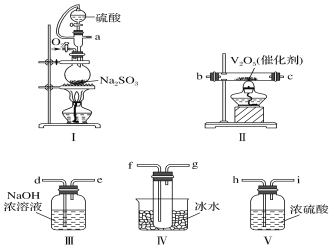 请根据要求回答问题: (1)各装置接口的连接顺序是a→__。 (2)装置Ⅳ烧杯中盛放冰水的作用是__。 (3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是__。 (4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是__。 (5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__。 |
|
| 16. | 详细信息 |
某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如图。 已知:298K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13 回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ为__,固体B为__(填化学式)。 (2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__。 (3)调节pH至2.9~3.2的目的是分离__(填离子符号) (4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为__。 ②若用amol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液VmL,所得红棕色固体C的物质的量为__(用含a、V的代数式表示) (5)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为__mol。 |
|
| 17. 综合题 | 详细信息 | ||||||||||||||||||||
|
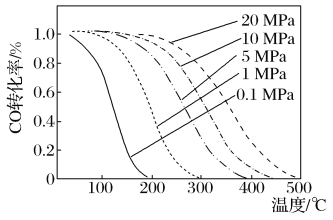
甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是: (ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1 另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1 (ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1 回答下列问题: (1)甲醇的燃烧热为__kJ·mol-1。 (2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__。 (3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是(_________) a.增大 b.减小 c.无影响 d.无法判断 (4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
|
|||||||||||||||||||||
| 18. 综合题 | 详细信息 |
|
第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。 (1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为__,该能层上具有的原子轨道数为__,电子数为__。 (2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?__(填“是”或“否”)。 (3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与__个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为__。 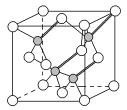 (4)与As同主族的短周期元素是N、P。AsH3中心原子杂化的类型__;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是__,理由是__。 (5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为__;设晶胞边长为acm,阿伏加德罗常数的值为NA,该晶体的密度为__g·cm-3(用含a和NA的式子表示)。  |
|
| 19. 推断题 | 详细信息 |
丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示: 已知: 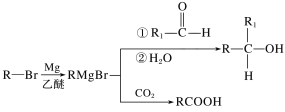 (1)B的化学名称是__,F中官能团名称是__。 (2)由E生成F的反应类型是__,由H生成J的反应类型是__。 (3)试剂a是__。 (4)J是一种环酯,则J的结构简式为__。H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为__。 (5)利用题中信息写出以乙醛和苯为原料,合成  的流程图(其他试剂自选)___。 的流程图(其他试剂自选)___。 |
|
最近更新