丘北县第二中学高一化学期末考试(2019年后半期)试卷完整版
| 1. 选择题 | 详细信息 |
|
下列关于合金的叙述中正确的是( ) A. 合金是由两种或多种金属熔合而成的 B. 日常生活中用到的5角硬币属于铜合金 C. 合金在任何情况下都比单一金属性能优良 D. 钢不属于合金 |
|
| 2. 选择题 | 详细信息 |
有一块镁铝合金,其中镁与铝的质量比是8:9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是( )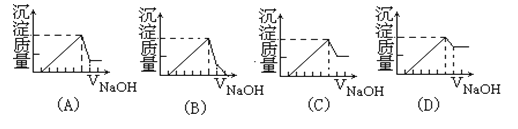 |
|
| 3. 选择题 | 详细信息 |
|
下列选项中的物质所含指定原子数目一定相等的是( ) A. 温度和压强不同,相同质量的一氧化二氮和二氧化碳两种气体的总原子数 B. 等温等压下,相同体积的乙烯和乙炔、乙烷的混合气体的总原子数 C. 等温等压下,相同体积的氧气和臭氧两种气体中的氧原子数 D. 相同物质的量、不同体积的氨气和甲烷两种气体中的氢原子数 |
|
| 4. 选择题 | 详细信息 |
|
天然氧化铝晶体俗称刚玉,常因含有杂质而呈各种色彩。下列叙述不正确的是( ) A. 刚玉中混入微量的铬元素称为红宝石 B. 刚玉中混入微量的钛元素或铁元素称为蓝宝石 C. 蓝宝石和红宝石都是制作名贵首饰的材料 D. 蓝宝石和红宝石都只能从自然界中来获得 |
|
| 5. 选择题 | 详细信息 |
|
NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( ) A. NH4Cl中的N元素被还原 B. 生成1 mol N2时转移的电子数为6 mol C. NaNO2是氧化剂 D. N2既是氧化剂又是还原剂 |
|
| 6. 选择题 | 详细信息 |
|
在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1 mol•L﹣1,SO42-的物质的量浓度为0.3 mol•L﹣1,则混合液中K+的物质的量浓度为( ) A. 0.15 mol•L﹣1 B. 0.45 mol•L﹣1 C. 0.3 mol•L﹣1 D. 0.6 mol•L﹣1 |
|
| 7. 选择题 | 详细信息 |
|
某种分散系的分散质粒子既能透过半透膜,也能透过滤纸,该分散系为( ) A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液 |
|
| 8. 选择题 | 详细信息 |
|
将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( ) A. 盐酸 B. 饱和氢氧化钠溶液 C. FeCl3溶液 D. CuSO4溶液 |
|
| 9. 选择题 | 详细信息 |
|
等质量的CO和N2,下列叙述不正确的是( ) A. 密度一定相同 B. 分子数一定相同 C. 原子数一定相同 D. 物质的量一定相同 |
|
| 10. 选择题 | 详细信息 |
|
二氧化硅是酸酐的原因是( ) A. 它溶于水得相应的酸 B. 它对应的水化物是可溶性强酸 C. 它与强碱溶液反应只生成盐和水 D. 它是非金属氧化物 |
|
| 11. 选择题 | 详细信息 |
|
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是 A. F2、K、HCl B. Cl2、Al、H2 C. NO2、Na、Br2 D. O2、SO2、H2O |
|
| 12. 选择题 | 详细信息 |
|
下列氧化还原反应发生在同种元素之间的是( ) A. Zn+2HCl===ZnCl2+H2↑ B. 2H2S+SO2===3S↓+2H2O C. H2+CuO |
|
| 13. 选择题 | 详细信息 |
|
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A—D四个实验,你认为结论不正确的是( ) A.将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 B.将表面积.质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 C.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 D.相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
|
| 14. 选择题 | 详细信息 |
|
下列元素中属于主族元素的是( ) A. 氖 B. 铜 C. 碘 D. 铁 |
|
| 15. 选择题 | 详细信息 |
|
下列实验中没有颜色变化的是( ) A. 木板上涂抹浓硫酸 B. 葡萄糖溶液与新制氢氧化铜悬浊液混合加热 C. 淀粉溶液中加入碘酒 D. 苯加入到酸性高锰酸钾溶液中 |
|
| 16. 选择题 | 详细信息 |
|
下列四种X溶液,均能跟盐酸反应,其中反应最快的是( ) A. 10 ℃ 3 mol·L-1的X溶液 B. 20 ℃ 3 mol·L-1的X溶液 C. 10 ℃ 2 mol·L-1的X溶液 D. 20 ℃ 2 mol·L-1的X溶液 |
|
| 17. 选择题 | 详细信息 |
|
下列过程中,共价键被破坏的是( ) A.碘升华 B.酒精溶于水 C.冰融化成水 D.HCl气体溶于水 |
|
| 18. 选择题 | 详细信息 |
|
下列叙述中不正确的是( ) A. 常温下乙醇是无色有特殊香味的液体,沸点比水低 B. 乙醇密度比水小,将乙醇加入水中,充分振荡后分层,上层为乙醇 C. 乙醇是一种常用的有机溶剂,能溶解许多有机物 D. 洗发时在水中加入适量的啤酒,油污容易洗净 |
|
| 19. 选择题 | 详细信息 |
|
19世纪中叶,门捷列夫的突出贡献是( ) A. 提出原子学说 B. 发现元素周期律 C. 提出化学元素的概念 D. 建立燃烧现象的氧化学说 |
|
| 20. 选择题 | 详细信息 |
|
下列关于“甲烷的存在与用途”的叙述不正确的是( ) A. 我国的天然气主要分布在中西部地区及海底 B. 可燃冰是天然气的水合物,外形似冰,易燃烧 C. 甲烷俗称“天然气”,常用作燃料 D. 天然气和沼气都是理想的清洁能源 |
|
| 21. 选择题 | 详细信息 |
|
将等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( ) A. 瓶内壁有油状液滴形成 B. 瓶中气体的黄绿色逐渐变浅 C. 反应的有机产物都为液体 D. 若日光直射可能发生爆炸 |
|
| 22. 选择题 | 详细信息 |
|
煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达到一定的浓度遇明火即迅速爆炸,其原因是( )。 A.粉末状态的煤比块状煤的着火点低 B.粉末状态的煤比块状煤放出的热量多 C.粉末状态的煤比块状煤的总表面积大 D.粉末状态的煤呈气态,属于可燃性气体 |
|
| 23. 选择题 | 详细信息 |
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是 A. OE段的平均反应速率最快 B. EF段,用盐酸表示该反应的平均反应速率为0.4 mol/(L·min) C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 D. F点收集到的CO2的量最多 |
|
| 24. 选择题 | 详细信息 |
|
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 下列叙述不正确的是( ) A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH- C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 D. 放电时正极附近溶液的碱性增强 |
|
| 25. 实验题 | 详细信息 |
|
工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。 工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:  (1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱 (2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。 (3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________ . |
|
| 26. 推断题 | 详细信息 |
某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验: 另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题: (1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。 (2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。 (3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。 (4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。 |
|
| 27. 综合题 | 详细信息 |
|
亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。 已知:①4Fe2++O2+4H+===4Fe3++2H2O ②硫酸亚铁在水中的溶解度如下图: 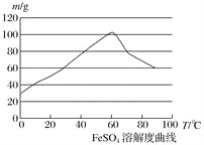 (1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。 (2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。 ①硫酸浓度应选择(填字母序号)__________; A.浓硫酸 B.10 moL·L-1硫酸 C.3 moL·L-1硫酸 D.任意浓度硫酸 ②温度宜控制在________,加热的同时需适当补充水,原因是___________________; ③反应中应保持 (3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。 |
|
| 28. 实验题 | 详细信息 |
探究苯与溴反应生成溴苯的实验可用如图所示装置,分析装置并完成下列题目: (1)关闭止水夹F,打开止水夹C,由A口向装有少量苯的三口烧瓶中加入过量液溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的有机化学方程式为______________________。 (2)D、E试管内出现的现象分别为:D.______, E.__________。 (3)待三口烧瓶中的反应进行到仍有气泡冒出时,松开止水夹F,关闭止水夹C,可以看到的现象是___________。 |
|
| 29. 推断题 | 详细信息 |
A、B是两种有刺激气味的气体。试根据下列实验事实填空。 (1)写出A~F各物质的化学式: A__________、B__________、C__________、D__________、E__________、F__________。 (2)写出A、B跟水反应的离子方程式:______________________。 |
|
| 30. 推断题 | 详细信息 |
烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示: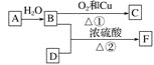 (1)写出决定B、D性质的重要原子团的名称: B________、D________。 (2)A的结构式为____________。 (3)写出下列反应的化学方程式并注明反应类型: ①______________________,反应类型:_______; ②_________________,反应类型:________。 (4)实验室怎样区分B和D?___________。 (5)除去F中少量B和D的最好试剂是________(填字母)。 A 饱和碳酸钠溶液 B 氢氧化钠溶液 C 苯 D 水 |
|
高中化学 试卷推荐
- 河南省南阳市鸭河工业南都实验中学2020-2021年高一上册10月月考化学题免费试卷
- 高一下册期末考试理综化学免费试卷带答案和解析(2019-2020年四川省眉山市)
- 2020届百校联考高考百日冲刺金卷全国Ⅱ卷 化学
- 2018-2019年高一前半期期中考试化学考题同步训练(内蒙古自治区正镶白旗察汗淖中学)
- 鲁科版选择性必修1第2章 化学反应的方向、限度与速率 第2节 化学反应的限度 课时1 化学平衡常数 平衡转化
- 2019-2020年高二下期期中考试化学试卷(浙江省宁波市北仑中学)
- 四川省成都市简阳市阳安中学2020-2021年高一上册期中考试化学试卷在线练习
- 陕西省榆林市第十二中学2021届高三上半年第三次月考化学试卷在线练习
最近更新



