上海市高三化学2019年上半年期中考试网上考试练习
| 1. 选择题 | 详细信息 |
|
下列化学用语的表述正确的是( ) A. 离子结构示意图 B. 比例模型 C. 氯化铵的电子式为  D. CO2的结构式为O—C—O |
|
| 2. 选择题 | 详细信息 |
|
新型小分子团水具有在人体内储留时间长、渗透效率高、生物利用度高等特点,下列关于小分子团水的说法正确的是 A.水分子的化学性质改变 B.水分子间的结构、物理性质改变 C.水分子内的作用力减小 D.水分子中氧氢键长缩短 |
|
| 3. 选择题 | 详细信息 |
|
能导电的电解质是 A.氯化钠溶液 B.金属铜 C.熔融硝酸钾 D.酒精 |
|
| 4. 选择题 | 详细信息 |
|
下列各离子化合物中,阳离子与阴离子的半径之比最大的是 A.KCl B.NaBr C.LiI D.KF |
|
| 5. 选择题 | 详细信息 |
|
砷(As)和镓(Ga)都是第四周期元素,分别属于ⅤA族和ⅢA族。下列说法中不正确的是 A. 原子半径:Ga>As>P B. 热稳定性:NH3>PH3>AsH3 C. 酸性:H3AsO4>H2SO4>H3PO4 D. Ga(OH)3可能是两性氢氧化物 |
|
| 6. 选择题 | 详细信息 |
|
下列物质的有关性质,能用共价键键能大小解释的是 A.还原性:HI>HF B.溶解度:HF>HI C.沸点:HF>HI D.热分解温度:HF>HI |
|
| 7. 选择题 | 详细信息 |
|
在锌粒和稀硫酸的反应体系,分别加入以下少量固体物质,对生成氢气的速率基本无影响的是 A.硫酸铜 B.氯化钙固体 C.烧碱 D.氧化铁 |
|
| 8. 选择题 | 详细信息 |
|
已知:2A(g) A.  B. B. C. 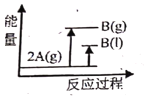 D. D. |
|
| 9. 选择题 | 详细信息 |
|
据报道,在 40GPa 高压下,用激光加热到 1800K,人们成功制得了某种 CO2 的晶体,其结构类似于 SiO2的结构,下列有关推断中错误的是 A.该晶体不可用作制冷材料 B.该晶体硬度大,可用作耐磨材料 C.该晶体有很高的熔点 D.该晶体中每个碳原子形成 2 个碳氧双键 |
|
| 10. 选择题 | 详细信息 |
|
下列说法正确的是 A.HF分子间存在着氢键,故HF分子比H2S分子稳定 B.晶体中只要有阳离子,就一定有阴离子 C.原子晶体中只存在非极性共价键 D.HClO4的酸性比H2SO4酸性强,说明氯的非金属性比硫强 |
|
| 11. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述中正确的是 A.31g白磷晶体中含有P-P键数是NA B.22.4LSO2含有NA个SO2分子 C.标准状况下,等质量的NO2和N2O4所含有原子个数相等 D.1molCl2通入热的NaOH溶液中(产物是NaCl、NaClO3),充分反应后转移的电子数为NA个 |
|
| 12. 选择题 | 详细信息 |
|
根据中学化学教材所附的元素周期表判断,下列叙述错误的是 A.K层电子数为奇数的所有元素所在的族的序数与该元素原子的K层电子数相等 B.L层电子数为奇数的所有元素所在的族的序数与该元素原子的L层电子数相等 C.L层电子数为偶数的所有元素所在的族的序数与该元素原子的L层电子数相等 D.M层电子数为奇数的所有元素所在族的序数与该元素原子的M层电子数相等 |
|
| 13. 选择题 | 详细信息 |
|
室温下,2H2(g)+O2(g) A.H2 B.若生成2mol水蒸气,则放出的热量大于566kJ C.2g氢气完全燃烧生成液态水所释放的能量为283kJ D.2mol氢气与1mol氧气的能量之和大于2mol液态水的能量 |
|
| 14. 选择题 | 详细信息 |
已知图一表示的是可逆反应 CO(g)+H2(g) A.图一 t2 时刻改变的条件可能是升高了温度或增大了压强 B.图一 t2 时刻改变的条件可能是通入了 CO 气体 C.图二 t1 时刻改变的条件可能是升高了温度或增大了压强 D.图二 t1 时刻改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
|
| 15. 选择题 | 详细信息 |
现定义pOH= A.图中线II的温度低于室温 B.图中五点Kw间的关系是:e>b>c>a>d C.c、d、e处的水溶液中的水的电离平衡一定被抑制 D.a点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性 |
|
| 16. 选择题 | 详细信息 | ||||||||
元素X、Y、Z位于相同短周期,它们的最高及最低化合价如图所示,下列判断错误的是
|
|||||||||
| 17. 选择题 | 详细信息 |
|
室温下,对于0.1mol/L的氨水,下列判断正确的是 A.用相同浓度的硝酸中和该氨水,硝酸体积小于氨水时,溶液可能呈中性 B.温度不变,加水稀释后溶液中c(NH4+)·c(OH-)不变 C.加水稀释后,溶液中导电粒子的数目减少 D.该溶液的pH=13 |
|
| 18. 选择题 | 详细信息 |
在密闭容器中,对可逆反应A+3B A.若正反应方向Q<0,则T1>T2 B.A可能为气体 C.压强增大时,混合气体的平均相对分子质量增大 D.B不一定为气体 |
|
| 19. 选择题 | 详细信息 |
|
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 A. a=b B. 混合溶液的PH=7 C. 混合溶液中,c(H+)= D. 混合溶液中c(H+)+c(B+)=c(OH-)+C(A-) |
|
| 20. 选择题 | 详细信息 |
|
向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( ) A. 共得到0.96g硫 B. 通入H2S的体积为336mL C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA |
|
| 21. 综合题 | 详细信息 | ||||||||
下表为元素周期表的一部分。
|
|||||||||
| 22. 填空题 | 详细信息 |
|
合成氨和制硫酸是中学阶段重要的化工生产反应。 (1)硫酸工业生产中接触室内发生的反应方程式为___;在实际生产过程中,操作温度选定400-500摄氏度,压强采用常压的原因分别是___。 (2)合成氨反应生成的氨气可用于工业制纯碱,写出以氨气、氯化钠、二氧化碳、水为原料制备纯碱的化学方程式___、___。 (3)合成氨每生成1g液氨,放出QkJ的热量,写出热化学反应方程式___。 (4)常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目____,该反应中被还原的是___,还原产物是___。 |
|
| 23. 综合题 | 详细信息 |
|
CH3COOH是中学化学中常用的一元弱酸,请回答下列问题: (1)设计简单实验证明CH3COOH为弱酸__。 (2)向0.1mol/L CH3COOH溶液中加蒸馏水稀释至100mL,在稀释过程中,下列量的变化是(“增大”、“减小”、“不变”或“不能确定”): n(H+)=___, (3)OH-浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是__(填写序号) ①反应需要的时间:CH3COOH>HCl ②开始反应的速率:HCl>CH3COOH ③参加反应的锌粉的物质的量:CH3COOH=HCl ④反应过程的平均速率:CH3COOH>HCl ⑤盐酸中有锌粉剩余 ⑥CH3COOH溶液中有锌粉剩余 (4)向饱和食盐水中滴加一定浓度的盐酸,对出现现象的预测可能正确的是__。 A.白色沉淀 B.液体分层 C.无明显现象 D.黄绿色气体 (5)现有下列溶液:①纯水;②pH=10的NaOH溶液;③pH=3的醋酸溶液;④pH=10的CH3COONa溶液。试比较四种溶液中水的电离程度的大小关系__。 |
|
| 24. 综合题 | 详细信息 |
某酯的合成路线如下图所示 (1)反应Ⅰ反应类型为___________________; D中含氧官能团为_____________写名称)。 (2)反应Ⅱ的反应条件为:_________________。 (3)C→D的化学反应方程式为________________________________________。 (4)写出一种满足下列条件的E的同分异构体的结构简式为__________________________。 ①能发生银镜反应 ②含苯环且苯环上一溴代物两种 ③不能与钠反应 (5)写出B合成 |
|
最近更新



