山东高二化学期中考试(2019年上半期)免费检测试卷
| 1. 选择题 | 详细信息 |
|
如下图所示装置中,属于电解池的是 ( ) A. 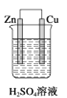 B.  C.  D.  |
|
| 2. 选择题 | 详细信息 |
|
下列措施能使Kw增大的是( ) A.温度不变向水中加入NaOH B.温度不变向水中加入H2SO4 C.温度不变向水中加入NaCl固体 D.加热升温 |
|
| 3. 选择题 | 详细信息 |
|
向蒸馏水中滴入少量盐酸后,下列说法中错误的是( ) A.c(H+)·c(OH-)乘积不变 B.c(H+)增加 C.c(OH-)降低 D.水电离出的c(H+)增加 |
|
| 4. 选择题 | 详细信息 |
|
关于强、弱电解质的叙述正确的是 A. 强电解质都是离子化合物,弱电解质都是共价化合物 B. 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C. 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 D. 强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱 |
|
| 5. 选择题 | 详细信息 |
|
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( ) A. a > c > d > b B. a > b > c > d C. c > a > b .> d D. b > d > c > a |
|
| 6. 选择题 | 详细信息 |
|
下面列出了电解不同物质的电极反应式,其中错误的是( ) A.以惰性电极电解饱和食盐水阴极:Na++e−═Na B.用铜电极电解CuSO4溶液阳极:Cu═Cu2++2e− C.以惰性电极电解熔融NaCl阴极:Na++e−═Na D.以惰性电极电解NaOH溶液阳极:4OH−═2H2O+O2↑+4e− |
|
| 7. 选择题 | 详细信息 |
|
下列有关盐类水解的说法中,不正确的是( )。 A. 盐类的水解过程破坏了纯水的电离平衡 B. 盐类的水解是酸碱中和反应的逆反应 C. 盐类水解后的溶液不一定显中性 D. |
|
| 8. 选择题 | 详细信息 |
右图为反应2SO2+O2 A.反应时间 B.温度 C.压强 D.SO2的浓度 |
|
| 9. 选择题 | 详细信息 |
|
下列各式中属于正确的水解方程式的是( ) A.NH4++H2O B.S2-+2H2O C.CH3COOH+H2O D.CH3COOH+OH-===CH3COO-+H2O |
|
| 10. 选择题 | 详细信息 |
大运会时深圳新能源汽车上有一种质子交换膜燃料电池,工作原理如图所示,下列叙述正确的是( ) A.通入氧气的电极发生氧化反应 B.通入氢气的电极为正极 C.总反应式为O2 +2H2 D.正极的电极反应式为O2 +4H+ +4e- =2H2O |
|
| 11. 选择题 | 详细信息 |
|
在由水电离的c(H+)=10−14 mol/L的溶液中,一定能大量共存的离子组是( ) A.K+、Fe2+、S2−、MnO4− B.Na+、Cl−、NO3−、SO42− C.Al3+、S2−、Cl−、SO42− D.Na+、HCO3-、Br−、Cl− |
|
| 12. 选择题 | 详细信息 |
|
下列溶液一定呈中性的是 ( ) A. pH=7的溶液 B. c(H+)=c(OH-)的溶液 C. 由强酸、强碱等物质的量反应得到的溶液 D. 非电解质溶于水得到的溶液 |
|
| 13. 选择题 | 详细信息 |
|
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于 A.1.7 B.2.0 C.12.0 D.12.4 |
|
| 14. 选择题 | 详细信息 |
|
常温下,将pH=5的硫酸稀释500倍,稀释后溶液中c(SO42-):c(H+)约为( ) A.1:1 B.1:12 C.1:10 D.10:11 |
|
| 15. 选择题 | 详细信息 |
|
稀释0.1mol·L-1的CH3COOH溶液过程中,以下各项数值增大的是() A.n(H+) B.c(CH3COO-) C. |
|
| 16. 选择题 | 详细信息 |
|
体积相同、pH相同的HCl溶液和CH3COOH溶液,用同浓度的NaOH溶液中和时 A.两者消耗NaOH的物质的量相同 B.中和HCl消耗NaOH的物质的量多 C.中和CH3COOH消耗NaOH的物质的量多 D.两者消耗NaOH的物质的量无法比较 |
|
| 17. 选择题 | 详细信息 |
|
下列物质的水溶液,由于水解而呈酸性的是( ) A. NaHSO4 B. Na2CO3 C. HCl D. AlCl3 |
|
| 18. 选择题 | 详细信息 |
|
在恒温恒容容器中发生N2O4(g)⇌2NO2(g),若反应物的浓度由0.1mol•L﹣1降到0.06mol•L﹣1需20s,那么由0.06mol•L﹣1降到0.036mol•L﹣1,所需反应时间为( ) A. 10 s B. 12 s C. 大于12 s D. 小于12 s |
|
| 19. 选择题 | 详细信息 |
|
同质量的锌与酸反应制备H2,欲使反应速率最大,下列条件中最佳组合是①纯锌片;②粗锌片;③0.01 mol/L盐酸;④0.01 mol/L硫酸;⑤98%硫酸;⑥加热;⑦用冰水冷却( ) A. ①③⑦ B. ②④⑥ C. ②③⑥ D. ①⑤⑥ |
|
| 20. 选择题 | 详细信息 |
|
在一密闭容器中充入一定量的N2和H2,发生反应N2(g)+3H2(g)⇌2NH3(g)经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L⋅s),则2s末NH3的浓度为( ) A.0.50mol/L B.0.60mol/L C.0.45mol/L D.0.55mol/L |
|
| 21. 计算题 | 详细信息 |
在水的电离平衡中,c(H+)和c(OH−)的关系如图所示: (1)A点水的离子积为1×10−14mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。 (2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______. (3)100℃时,若盐酸中c(H+)=5×10−4 mol/L,则由水电离产生的c(H+)是________ |
|
| 22. 填空题 | 详细信息 |
|
(1)常温下0.01 mol·L-1HCl溶液: ①由水电离出的c(H+)=________; ②pH=________; ③加水稀释100倍,pH=________。 (2)常温下0.01 mol·L-1NaOH溶液: ①pH=________; ②加水稀释100倍,pH=________。 |
|
| 23. 填空题 | 详细信息 |
|
有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。 (1)该学生的操作是________(填“正确”或“错误”),其理由是______________。 (2)若用此法分别测定c(H+)相等的盐酸与醋酸溶液的pH,误差较大是__________,其理由是__________。 (3)用湿润的pH试纸测定下列溶液的pH,测定结果不变的是__________。 A HCl溶液 B NaOH溶液 C Na2SO4溶液 D 氨水 |
|
| 24. 填空题 | 详细信息 |
|
在密闭容器内,使1molN2和3molH2混合发生下列反应:3H2+N2 (1)合成氨时选择500℃高温的目的是______________。 (2)当反应达到平衡时,N2和H2的浓度比是_______。 (3)当达到平衡吋,充入氩气,并保持体积不变,平衡将______移动。 (4)当达到平衡时,充入氩气,并保持压强不变,平衡将______移动,反应速率将_______。 (5)当达到平衡时,充入N2并保持体积不变,平衡将______移动。 (6)当达到平衡时,保持体积不变,升高温度时,混合气体的平均相对分子质量_______(选填“增大”“减小”或“不变”,后同),密度________。 |
|
| 25. 计算题 | 详细信息 |
|
已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是___________________________________。 |
|
| 26. 计算题 | 详细信息 |
|
已知密闭容器中发生如下反应:X(g)+2Y(g) |
|
最近更新



