洛阳市高一化学上册期末考试试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生活密切相关。下列说法的是 A.合金具有优良性能,可用于制造新型金属材料 B.氧化铁俗称铁红,可用作红色油漆和外墙涂料 C.二氧化硫具有漂白性,常用来漂白食品 D.A12O3可用作耐高温材料,A1(OH)3可用于中和过多的胃酸 |
|
| 2. 选择题 | 详细信息 |
|
下列化学药品与警示语对应正确的是( ) ①酒精——剧毒品 ②浓硫酸——腐蚀品 ③汽油——易燃品 ④烧碱——剧毒品 ⑤氯酸钾——氧化剂 ⑥硝酸铵——爆炸品 A. ①②③⑥ B. ①②⑤ C. ①④⑤ D. ②③⑤⑥ |
|
| 3. 选择题 | 详细信息 |
|
下列有关物质分类正确的是 A. 氯水、氨水均为电解质 B. Na2O2为碱性氧化物 C. NaOH、NH3·H2O都为可溶性碱 D. 蛋白质溶液、液氯均属于分散系 |
|
| 4. 选择题 | 详细信息 |
|
铝制器皿能够盛放的物质是 A. KOH溶液 B. 浓硫酸 C. NaOH溶液 D. 稀硫酸 |
|
| 5. 选择题 | 详细信息 |
|
下列变化中不涉及氧化还原反应的是 A. 由氯气制漂白粉 B. 由铝土矿冶炼铝 C. 由水玻璃制硅胶 D. 由黄铁矿(FeS2) 制 SO2 |
|
| 6. 选择题 | 详细信息 |
|
下列说法正确的是 ①FeO不稳定,在空气里受热就迅速被氧化成Fe3O4 ②碘酒、豆浆、牛奶、淀粉溶液都是胶体 ③新型陶瓷、玛瑙、玻璃都不是硅酸盐产品 ④水玻璃、纯碱、氧化钙 都是电解质 ⑤浓硝酸和浓盐酸按体积比1:3混合叫做王水,能使一些不溶于硝酸的金属溶解 A.①⑤ B.③④ C.②⑤ D.②③ |
|
| 7. 选择题 | 详细信息 |
下列陈述I、Ⅱ正确并且有因果关系的是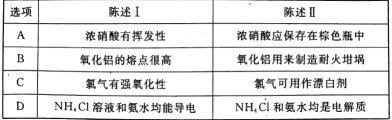 A.A B.B C.C D.D |
|
| 8. 选择题 | 详细信息 |
|
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可判断丙物质是( ) A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4 |
|
| 9. 选择题 | 详细信息 |
|
下列物质既能与盐酸反应,又能与烧碱溶液反应的是 ① NaHSO4 ② A1 ③ Al(OH)3 ④ A12O3 ⑤ NaHCO3 ⑥ SiO2 A.②③④⑤ B.①②③④⑤ C.②③④ D.全部都可以 |
|
| 10. 选择题 | 详细信息 |
|
氢化钠(NaH)是一种生氢剂,可发生反应:NaH + H2O = NaOH + H2 ↑,对这一反应的描述正确的是 A.NaH是氧化剂 B.氧化产物和还原产物的质量比是1:1 C.NaOH是还原产物 D.生成1 molH2转移2 mol电子 |
|
| 11. 选择题 | 详细信息 |
|
下列有关氯气及其化合物的说法错误的是 A.氯气能与大多数金属化合,其一般将变价金属氧化至最高价 B.干燥的氯气和氯水均能使鲜花褪色 C.因为氯气有毒,所以可用于杀菌、消毒、漂白 D.除去氯气中少量氯化氢可使气体通过饱和食盐水 |
|
| 12. 选择题 | 详细信息 |
|
设NA为阿伏伽德罗常数的值。下列说法正确的是 A.0.1 mol氯气通入水中,转移电子的数目为0.1NA B.常温常压下,7.8 g过氧化钠中含有阴离子的数目为0.2NA C.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA D.标准状况下,22.4L C12与足量的铁充分反应,转移的电子数为3NA |
|
| 13. 选择题 | 详细信息 |
|
下列实验设计正确的是 A.将混有HC1气体的CO2通入装有饱和碳酸钠溶液的洗气瓶,可除去HC1 B.用向上排空气法收集铜粉与稀硝酸反应产生的NO C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 D.将SO2通入KMnO4酸性溶液证明SO2具有还原性 |
|
| 14. 选择题 | 详细信息 |
下面表格中的实验操作、实验现象和结论均正确且相符的是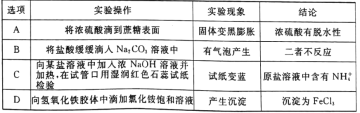 A.A B.B C.C D.D |
|
| 15. 选择题 | 详细信息 |
|
将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( ) A.1mol B.0.05mol C.1.05mol D.0.11mol |
|
| 16. 选择题 | 详细信息 |
将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量的关系如下图所示,符合图示情况的是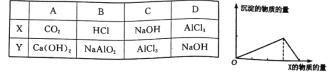 A.A B.B C.C D.D |
|
| 17. 选择题 | 详细信息 |
—定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴 滴入某浓度稀盐酸,加入V(HC1)与生成n(CO2)的关系如图所示。下列有关叙述正确的是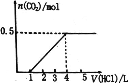 A.通入的CO2气体为11.2 L B.A溶液中 n(NaHCO3) = 2n(Na2CO3) C.A溶液中既含有NaOH,又含有Na2CO3 D.A溶液中可能含有NaOH和NaHCO3 |
|
| 18. 填空题 | 详细信息 |
|
化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题: (1)明矾可用作净水剂,其化学式是________,漂白粉的有效成分是_______(填化学式)。 (2)小苏打通常用来治疗胃酸过多,请用离子方程式解释原因_________。 (3)驰名世界的中国瓷器通常是由黏土经高温烧结而成。黏土的主要成分为 Al2Si2O3(OH)x,式中x=_______,若以氧化物形式表示黏土的组成,应写为:_________。 (4)洁厕灵(强酸性,含盐酸)与84消毒液(含NaClO)混用可产生一种黄绿色有毒气体,请写出该反应的离子方程式_________。 |
|
| 19. 综合题 | 详细信息 |
|
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为________,检验溶液中还有Fe3+的试剂是_________。 (2)—定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为___________。 (3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_________。 (4)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中 CO和CO2物质的量之比为_________。 |
|
| 20. | 详细信息 |
某课外小组研究铝土矿中A12O3的含量。查阅资料得知,铝土矿的主要成分是A12O3 ,杂质是Fe2O3、SiO2等。从铝土矿中提取A12O3的过程如下: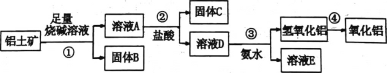 (1)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:______。 (2)第②步用到的分离方法是_______。 (3)请从下面仪器中选出第④步操作不需要的仪器_____________(填字母) A.蒸发皿 B.玻璃棒 C.泥三角 E.酒精灯 F.坩埚 (4)将实验过程中所得固体准确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中A12O3 的质量分数__________(结果保留一位小数)。 |
|
| 21. 实验题 | 详细信息 |
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置: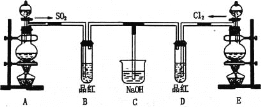 (1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________ (2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____、D______,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____、D______。 (3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________。 |
|
| 22. 计算题 | 详细信息 |
某同学取一定质量的铁铝合金与100 mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入2 mol/L NaOH溶液,所加 NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示: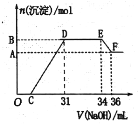 (1)写出EF段发生反应的离子方程式____________ (2)C点对应的溶液中含有的阳离子除Na+外,还含有_______。 (3)x =________。 (4)铁铝合金中铝的物质的量分数为_________。 |
|
最近更新



