韶关市同步练习
| 1. 选择题 | 详细信息 | |||||||||||||||
分类是科学研究的重要方法,下列物质分类不正确的是
|
||||||||||||||||
| 2. 选择题 | 详细信息 |
|
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( ) A.溶液中有固体析出,Na+数目增加 B.溶液中有气体逸出,溶液碱性增大 C.溶质的质量分数增大 D.溶液中Na+数目减少,溶质的质量分数不变 |
|
| 3. 选择题 | 详细信息 |
|
下列有关钠的化合物说法正确的是( ) A.将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 B.用加热法除去NaHCO3固体中混有的Na2CO3 C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+ D.钠蒸气充入灯泡中制成钠灯,常用于公路照明 |
|
| 4. 选择题 | 详细信息 |
|
处处留心皆知识,生活中的下列事实,不涉及到氧化还原反应的是 A.小苏打用作食品膨松剂 B.铁钉生锈 C.火法炼铜 D.食物腐败变质 |
|
| 5. 选择题 | 详细信息 |
|
实验过程中,下列溶液的导电能力变化不大的是( ) A.Ba(OH)2溶液中滴入H2SO4溶液 B.水中滴入盐酸 C.澄清石灰水中通入少量CO2 D.HCl溶液中加入适量的NaOH固体 |
|
| 6. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是( ) A.稀硫酸滴到铜片上:Cu+2H+ = Cu2++H2↑ B.硫酸铜溶液与氨水反应的离子方程式:Cu2++2OH- = Cu(OH)2↓ C.氢氧化铝中和胃酸:Al(OH)3 + 3H+ = Al3+ + 3H2O D.用 FeCl3溶液腐蚀印刷电路板:Fe3+ + Cu = Fe2+ + Cu2+ |
|
| 7. 选择题 | 详细信息 |
|
下列各组离子在给定条件下能大量共存的是( ) A.在无色透明溶液中: K+、N B.在使紫色石蕊溶液变蓝的溶液中:Na+、Mg2+、Ca2+、I- C.在pH=1的溶液中:K+、Ba2+、HC D.在滴加酚酞试液显红色的溶液中:Na+、S2-、C |
|
| 8. 选择题 | 详细信息 |
|
氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+ H2↑。下列有关该反应的说法中,正确的是 A.该反应属于置换反应 B.该反应属于复分解反应 C.NaH是氧化剂 D.H2O中的氢元素被还原 |
|
| 9. 选择题 | 详细信息 |
|
鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是( ) A.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 C.分别逐滴加入1 mol·L-1的盐酸,看产生气泡的先后 D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
|
| 10. 选择题 | 详细信息 |
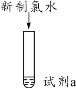
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是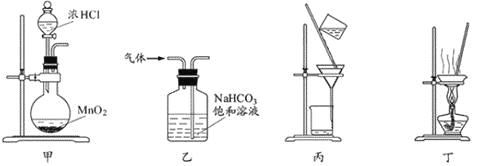 A. 用装置甲制取氯气 B. 用装置乙除去氯气中的少量氯化氢 C. 用装置丙分离二氧化锰和氯化锰溶液 D. 用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
|
| 11. 选择题 | 详细信息 |
如图所示,从A处通入新制备Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,当打开B阀后,C处红色布条逐渐褪色,D瓶中盛放的溶液可能是( )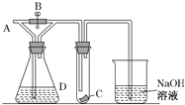 ①浓硫酸 ②饱和NaCl溶液 ③NaOH溶液 ④H2O A.①② B.①③ C.②④ D.③④ |
|
| 12. 选择题 | 详细信息 | |||||||||||||||||
为探究新制氯水的性质,某学生做了如下实验。
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是 |
||||||||||||||||||
| 13. 选择题 | 详细信息 |
|
氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。涉及如下化学反应: ①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O ②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O; ③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O 下列有关叙述正确的是( ) A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 B.反应①中Se是氧化产物,I2是还原产物 C.反应①中生成6分子I2,转移的电子数目为24个 D.反应②、③中等质量的Se消耗H2SO4和HNO3的分子数之比为2∶1 |
|
| 14. 选择题 | 详细信息 |
向NaOH和Na2CO3混合溶液中滴加1 mol/L的稀盐酸,CO2的生成量与加入盐酸的量的关系如图所示。下列判断正确的是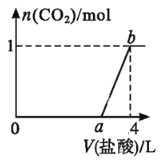 A.在0~a范围内,只发生中和反应 B.ab段发生反应的离子方程式为CO C.a=3 D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2 |
|
| 15. 选择题 | 详细信息 | |||||||||||||||
已知①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;②Fe3+与KSCN反应溶液变为红色。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。表中由实验现象得出的结论完全正确的是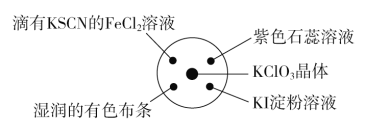
|
||||||||||||||||
| 16. 选择题 | 详细信息 |
在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是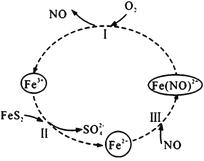 A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O B.反应Ⅱ的氧化剂是Fe3+ C.反应Ш是氧化还原反应 D.黄铁矿催化氧化中NO作催化剂 |
|
| 17. 填空题 | 详细信息 |
|
有下列物质:①氢氧化钡固体 ②Al2(SO4)3③液态HCl ④稀硫酸 ⑤二氧化碳 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖 ⑨熔融氯化钠 ⑩ (1)可以导电的有______________,属于电解质的有____________,属于非电解质的有__________, (2)②在水中的电离方程式为__________________________________________, (3)请写出④与⑥反应的离子方程式____________________________________, (4)请写出⑤与①的溶液反应的离子方程式____________________________________。 (5)请写出⑤通入⑦溶液反应的离子方程式____________________________________。 (6)物质③HCl具有_______________(填写“氧化性”、“还原性”或者“氧化性和还原性”),理由是____________________,物质⑥铁在氧化还原反应中应该只能表现___________(填“氧化性”和“还原性”)。 |
|
| 18. 填空题 | 详细信息 |
|
(Ⅰ)储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。 请回答下列问题: (1)此反应的氧化剂是________,氧化产物是________。 (2)H2SO4在上述反应中表现出来的性质是________(填选项序号)。 A.酸性 B.氧化性 C.吸水性 D.脱水性 (Ⅱ)饮用水中的NO (3)上述反应中,被氧化的元素________,还原产物是________。 (4)用双线桥法表示上述反应中电子转移的方向和数目:____________。 (5)请配平下列离子方程式。 _____Fe2++_____H++_____NO |
|
| 19. 实验题 | 详细信息 | ||||||||||||
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验仪器,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。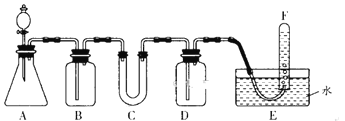 (1)A是制取CO2的装置,写出A中发生反应的离子方程式______________。 (2)填写表中空格:
|
|||||||||||||
| 20. 实验题 | 详细信息 |
|
含氯消毒剂是消毒剂中常用的一类产品。 I.某实验小组用如图装置制备家用消毒液。 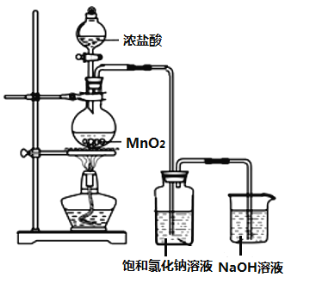 (1)图中盛装浓盐酸的仪器名称是___________,写出利用上述装置制备消毒液涉及的化学反应方程式,制氯气的反应方程式:__________,制消毒液的反应方程式:_____________。此方法获得的消毒液的有效成分是_________(填名称)。 (2)洗气瓶中饱和氯化钠溶液的作用是_____________。 (3)此消毒液在使用时应注意一些事项,下列说法正确的是_____________。 a.与洁厕灵(含盐酸)混合使用效果更好 b.可以用于瓷砖、大理石地面的消毒 c.可以用于皮肤消毒 (4)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(g)+8NH3(g)=6NH4Cl(s)+N2(g),若反应中消耗Cl2 1.5个,则被氧化的NH3为______个,该过程中电子转移的总数为____个。 II.(5)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。氯酸钠与盐酸在50℃的条件下反应得到二氧化氯和氯气的混合气体。 控制50℃的加热方法是______,写出该反应的化学方程式___________。 |
|
最近更新