林州市高一化学下册月考试卷同步考试检测
| 1. 选择题 | 详细信息 |
|
关于元素周期表的说法正确的是 A. 元素周期表有8个主族 B. ⅠA族的元素全部是金属元素 C. 短周期是指第一、二周期 D. 元素周期表有7个周期 |
|
| 2. 选择题 | 详细信息 |
|
下列关于周期表的说法正确的是( ) A.同一周期元素原子的最外层电子数相同 B.同一主族元素原子的电子层数相同 C.能生成碱的金属都在第ⅠA族 D.第三周期有8种元素 |
|
| 3. 选择题 | 详细信息 |
|
2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号 (缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)。下列说法正确的是 A. 113号元素的氧化物为两性氧化物 B. 115号元素位于第六周期第VA族 C. 117号元素的某种原子,核内含176个中子,此原子是 D. 118号元素的原子最外层有8个电子 |
|
| 4. 选择题 | 详细信息 |
|
下面是元素周期表的一部分(表中数字和X代表原子序数),其中X为53的是 A. 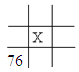 B. B. 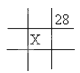 C. C.  D. D. 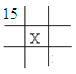 |
|
| 5. 选择题 | 详细信息 | ||||||||||
已知下列元素的半径为:
|
|||||||||||
| 6. 选择题 | 详细信息 |
|
下列关于碱金属和卤素的说法中,错误的是( )。 A.随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大 B.碱金属元素中,锂原子失去电子的能力最弱,卤素中,氟原子得电子能力最强 C.钾与水的反应比钠与水的反应更剧烈 D.溴单质与水反应比氯单质与水反应更剧烈 |
|
| 7. 选择题 | 详细信息 |
|
a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是() A. a与其他三种元素形成的二元化合物中其化合价均为+1 B. b与其他三种元素均可形成至少两种二元化合物 C. c的原子半径是这些元素中最大的 D. d和a形成的化合物的溶液呈弱酸性 |
|
| 8. 选择题 | 详细信息 |
|
根据原子结构及元素周期律的知识,下列推断正确的是( ) A.同主族元素氧化物对应的水化物酸性随核电荷数的增大而增强 B.元素性质呈周期性变化的决定因素是元素的相对原子质量依次递增 C.Cl-、S2-、Ca2+、K+半径逐渐减小 D. |
|
| 9. 选择题 | 详细信息 |
|
下列化合物中,阴离子和阳离子的半径之比最大的是() A. CsI B. NaF C. LiI D. KCl |
|
| 10. 选择题 | 详细信息 |
|
能证明铝的金属性比镁弱的实验事实是 A.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能 B.铝的原子半径比镁小 C.镁与浓硫酸反应,铝与冷的浓硫酸不反应 D.铝的金属光泽不如镁显著 |
|
| 11. 选择题 | 详细信息 |
短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如图所示。下列说法正确的是 A.X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X B.Q元素形成的可溶性盐的溶液不可能显酸性 C.X、Y、R形成的某种化合物可以用于漂白、消毒 D.Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应 |
|
| 12. 选择题 | 详细信息 |
|
下列有关氢化物的叙述中正确的是( ) A. 稳定性:H2S>HF B. HCl的电子式为 C. 一个D2O分子所含的中子数为8 D. 在卤化氢中HF最稳定 |
|
| 13. 选择题 | 详细信息 |
|
下列物质中有极性共价键的是( ) A. 单质碘 B. 氯化镁 C. 溴化钾 D. 水 |
|
| 14. 选择题 | 详细信息 |
|
下列电子式正确的是( ) A.氨: B.氯化钠: C.氮气: D.二氧化碳: |
|
| 15. 选择题 | 详细信息 |
|
下列说法正确的是 A. 仅由非金属元素不可能形成离子化合物 B. 构成分子的粒子一定含有共价键 C. 离子化合物中可能含有非极性共价键 D. 凡是有化学键断裂过程一定发生了化学反应 |
|
| 16. 选择题 | 详细信息 |
|
下列表示物质结构的化学用语或模型正确的是 A. HF的电子式: C. HClO的结构式: H-Cl-O D. 用电子式表示CO2的形成过程: |
|
| 17. 选择题 | 详细信息 |
|
下列每组中各物质内既有离子键又有共价键的一组是 A.Na2O2、KOH、Na2SO4 B.MgO、Na2SO4、NH4HCO3 C.NaOH、H2SO4、(NH4)2SO4 D.HCl、Al2O3、MgCl2 |
|
| 18. 选择题 | 详细信息 |
|
下列说法正确的是 A.需要加热才能发生的反应一定是吸热反应 B.放热反应在常温下一定很容易发生 C.放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 D.吸热反应发生过程中要不断从外界获得能量,放热反应不需要外界能量 |
|
| 19. 选择题 | 详细信息 |
已知反应A+B=C+D的能量变化如图所示,下列关于此反应的说法不正确的是( )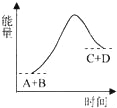 A.是吸热反应 B.只有在加热条件下才能进行 C.生成物的总能量高于反应物的总能量 D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
|
| 20. 选择题 | 详细信息 |
|
下列有关能量转换的说法不正确的是( ) A. 煤燃烧是化学能转化为热能的过程 B. 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 C. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程 |
|
| 21. 选择题 | 详细信息 |
下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( ) ①Mg(s)所具有的能量高于MgX2(s)所具有的能量 ②MgCl2电解制Mg(s)和Cl2(g)是吸热过程 ③热稳定性:MgI2>MgBr2>MgCl2>MgF2 ④常温下氧化性:F2<Cl2<Br2<I2 A. 1项 B. 2项 C. 3项 D. 4项 |
|
| 22. 选择题 | 详细信息 |
下列过程中能量的转化与图示吻合的是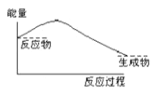 A. 铵盐溶于水 B. C与CO 2 (g)反应 C. 水结成冰 D. 断开氢气中的H—H键 |
|
| 23. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.放热反应在常温下一定很容易发生 C.反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断 D.吸热反应在常温下一定不能发生 |
|
| 24. 选择题 | 详细信息 |
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U形管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是( ) ①在外电路中,电流由铜电极流向银电极; ②正极反应为Ag++e-=Ag; ③实验过程中取出盐桥,原电池仍继续工作; ④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同; A.①② B.③④ C.②④ D.②③ |
|
| 25. 选择题 | 详细信息 |
|
有关电化学知识的描述正确的是( ) A. CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 B. 某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中一定是银作正极 C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极、铜作正极 D. 理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
|
| 26. 选择题 | 详细信息 |
依据氧化还原反应2Ag++Cu=Cu2++2Ag设计的原电池如图所示。下列有关说法不正确的是( )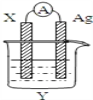 A. 电极X的材料是Cu B. 电解质溶液Y是CuSO4溶液 C. 电子从X电极经导线流向Ag电极 D. Ag电极为电池的正极,电极反应为Ag++e- =Ag |
|
| 27. 选择题 | 详细信息 |
|
下列装置可以构成原电池的是( ) A.  B. B.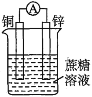 C. 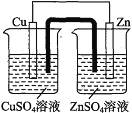 D. D. |
|
| 28. 选择题 | 详细信息 |
根据反应:2Ag+ + Cu = Cu2+ + 2Ag,设计如图所示原电池,下列说法错误的是( )。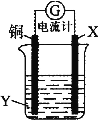 A.X可以是银或石墨 B.Y是硫酸铜溶液 C.电子从铜电极经外电路流向X电极 D.X极上的电极反应式为Ag+ + e-= Ag |
|
| 29. 选择题 | 详细信息 |
某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是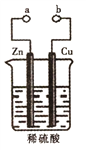 A. a和b不连接时,锌片上有气体生成,该装置不能形成原电池 B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑ C. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn D. 无论a和b是否连接,稀硫酸均参与反应 |
|
| 30. 推断题 | 详细信息 | ||||||||||||
A、B、C、D、E是五种短周期主族元素。已知:
|
|||||||||||||
最近更新



