高一下学期第二次月考化学题带参考答案(2019-2020年辽宁省铁岭市开原市高级中学)
| 1. 选择题 | 详细信息 |
|
分子式为C4H8O2且能与NaHCO3反应生成CO2的有机物共有( ) A.1种 B.2种 C.3种 D.4种 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是 A. SO2 能使品红溶液褪色,其漂白原理与氯水相同 B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO C. 浓硫酸与过量的锌反应,可以得到无色具有刺激性气味的混合气体 D. 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验生成的气体 |
|
| 3. 选择题 | 详细信息 | |||||||||||||||
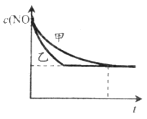
一定条件下,可逆反应2A(g)
|
||||||||||||||||
| 4. 选择题 | 详细信息 |
|
下列表示物质结构的化学用语或模型正确的是( ) A.乙醇的电子式: 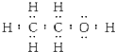 B.乙烷的空间填充模型: B.乙烷的空间填充模型: C.乙酸的分子式:CH3COOH D.乙烯的结构简式:CH2CH2 |
|
| 5. 选择题 | 详细信息 |
|
1mol乙烯与氯气发生完全加成反应,然后该加成反应的产物与足量的氯气在光照条件下发生完全取代反应,则两个过程消耗氯气的总物质的量为( ) A.3mol B.4mol C.5mol D.6mol |
|
| 6. 选择题 | 详细信息 |
|
有如下实验现象:①澄清石灰水变浑浊 ②湿润的红色石蕊试纸变蓝 ③使品红溶液褪色 ④通入足量的氢氧化钠溶液中,再滴加氯化钡溶液时有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中能使溴水褪色,且滴加氯化钡溶液有白色沉淀产生。其中能证明有SO2的是( ) A. ①②③④⑤ B. 都不能证明 C. ③④⑤ D. ⑤ |
|
| 7. 选择题 | 详细信息 |
|
一定温度下,反应N2(g)+O2(g)⇌2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( ) A.缩小体积使压强增大 B.恒容,充入N2 C.恒容,充入He D.恒压,充入He |
|
| 8. 选择题 | 详细信息 |
|
在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( ) ①1.2 mL ②2.4 mL ③3 mL ④4 mL A.①② B.②③ C.③④ D.①④ |
|
| 9. 选择题 | 详细信息 |
|
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是( ) A.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 B.为防止富脂食品氧化变质,常在包装袋中放入生石灰 C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济 D.“静电除尘”“燃煤固硫”“汽车尾气催化净化”都能提高空气质量 |
|
| 10. 选择题 | 详细信息 |
科学家已获得了气态 A. B.1mol C.1mol D. |
|
| 11. 选择题 | 详细信息 |
|
在373K时,密闭容器中充入一定物质的量的NO2和SO2,发生如下反应:NO2+SO2 A.SO2、NO2、NO、SO3的物质的量一定相等 B.NO2和SO2的物质的量一定相等 C.平衡体系中总物质的量一定等于反应开始时总物质的量 D.NO和SO3的物质的量一定不相等 |
|
| 12. 选择题 | 详细信息 |
|
相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液中进行的)中,ΔH1>ΔH2的是 A.2H2(g)+O2(g)=2H2O(l) ΔH1;CaCO3(s)=CaO(s)+CO2(g) ΔH2 B.C2H5OH(l)+3O2(g==2CO2(g)+3H2O(l) ΔH1;C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH2 C.HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH1;HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ΔH2 D.CO2(g)=CO(g)+1/2O2(g) ΔH1;2CO2(g)=2CO(g)+O2(g) ΔH2 |
|
| 13. 选择题 | 详细信息 |
|
在密闭容器中进行如下反应:X2(g)+Y2(g) A.Y2为0.2mol·L-1 B.Y2为0.35mol·L-1 C.X2为0.2mol·L-1 D.X2为0.15mol·L-1、Z为0.25mol·L-1 |
|
| 14. 选择题 | 详细信息 | ||||||||
已知1mol二氧化硅晶体中化学键的数目为4NA,有关键能数据如表所示:
|
|||||||||
| 15. 选择题 | 详细信息 |
|
在氧气中灼烧FeS、 A. |
|
| 16. 选择题 | 详细信息 |
我国最近在太阳能光电催化一化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是( ) A.该工艺中光能最终转化为化学能 B.该装置工作时,H+由b极区流向a极区 C.a极上发生的电极反应为Fe3++e-=Fe2+ D.a极区需不断补充含Fe3+和Fe2+的溶液 |
|
| 17. 选择题 | 详细信息 |
|
完全燃烧mg液态乙醇得到液态水时放出的热量为akJ,经测定mg乙醇与Na反应时最多可生成0.5gH2,则液态乙醇完全燃烧的热化学方程式为( ) A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ∆H=-akJ·mol-1 B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ∆H=+ C. D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ∆H=-2akJ·mol-1 |
|
| 18. 选择题 | 详细信息 |
|
下列醇类物质中,能被氧化成醛的是( ) A.CH3CH2CH2OH B. C.  D. D. |
|
| 19. 填空题 | 详细信息 |
|
(1)已知2 mol氢气燃烧生成液态水时放出572 kJ的热量,反应方程式是2H2(g)+O2(g)===2H2O(l)。请回答下列问题: (1)①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。 ②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。 (2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时: 2SO2(g)+O2(g) H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1 2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1 则SO3(g)与H2O(l)反应的热化学方程式是_________________ 。 (3)已知下列反应的热化学方程式: ①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1 ②2H2(g)+O2(g)===2H2O(g) ΔH2 ③C(s)+O2(g)===CO2(g) ΔH3 则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为________。 |
|
| 20. 实验题 | 详细信息 | ||||||||||||||||||||||||||||||
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题: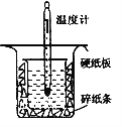 (1)从图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是____________________________。 (2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和反应生成1molH2O时的反应热__________(填“相等”“不相等”)。 (3)实验数据如下表:①请填写下表中的空白:
|
|||||||||||||||||||||||||||||||
| 21. | 详细信息 | ||||||||||||||||||||
|
汽车尾气中含有CO、NO等有害气体。 (1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示: 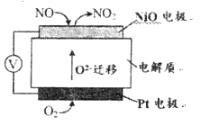 ①NiO电极上发生的是_________反应(填“氧化”或“还原”)。 ②外电路中,电子的流动方向是从_____电极流向_____电极(填“NiO”或“Pt”);Pt电极上的电极反应式为___________。 (2)一种新型催化剂能使NO和CO发生反应:2NO+2CO
|
|||||||||||||||||||||
| 22. | 详细信息 |
A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,H为一元强碱,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题: (1)A所含元素在周期表中的位置为_________________,C的电子式为_____________。 (2)A与H在加热条件下反应的离子方程式为_______________________________________。 (3)将A溶于沸腾的G溶液中可以制得化合物I,I的化学式为Na2S2O3,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为___________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为______________________________。 |
|