高二下半年期末考试化学免费试卷完整版(2019-2020年辽宁省沈阳市郊联体)
| 1. 选择题 | 详细信息 |
|
下列推论正确的 A. B. C. D. |
|
| 2. 选择题 | 详细信息 |
高温下,超氧化钾晶体 A. B.晶体中,所有原子之间都是以离子键结合 C.晶体中与每个 D.超氧化钾化学式为 |
|
| 3. 选择题 | 详细信息 |
化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是 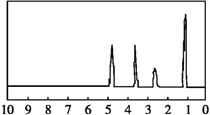 A. A分子属于酯类化合物,在一定条件下能发生水解反应 B. A在一定条件下可与3 mol H2发生加成反应 C. 与A属于同类化合物的同分异构体只有4种 D. 符合题干特征的A分子结构只有1种 |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是() A.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液,再滴加硝酸银溶液 B.苯的硝化反应,在配制混合酸时,应先在试管中加入浓硫酸,再慢慢加入浓硝酸 C.实验室制取乙炔时,气体常有臭鸡蛋气味,应用硫酸铜溶液洗气 D.向苯和溴水的混合物中加入铁屑即可反应 |
|
| 5. 选择题 | 详细信息 |
芳樟醇常用于合成香精,香叶醇存在于香茅油、香叶油、香草油和玫瑰油等物质中,有玫瑰花和橙花香气,它们的键线式如图所示。下列说法不正确的是() A.两种醇都能与溴水反应 B.两种醇互为同分异构体 C.两种醇与氧气在铜的催化作用下,均可以被氧化为相应的醛 D.两种醇中只有香叶醇与氧气在铜的催化作用下,可被氧化为相应的醛 |
|
| 6. 选择题 | 详细信息 |
已烯雌酚是一种激素类药物, 其结构简式如下图,下列有关叙述中正确的是() A.l mol该有机物可以与5mol Br2发生反应 B.可与NaOH和NaHCO3溶液发生反应 C.遇FeCl3溶液不能发生显色反应 D.该有机物分子中一定有16个碳原子共平面 |
|
| 7. 选择题 | 详细信息 |
|
下列叙述正确的是() A.HCHO+ B.能发生银镜反应的有机物一定属于醛 C.分子式为C9H10O2能与NaOH溶液反应且苯环上有一个侧链的有机物共有 4 种 D.除去乙酸乙酯中的乙酸,可以加入饱和碳酸钠溶液后分液 |
|
| 8. 选择题 | 详细信息 |
|
有下列几种反应类型:①消去、②加聚、③水解、④加成、⑤还原、⑥氧化。用丙醛制取1,2-丙二醇,按正确的合成路线依次发生的反应所属类型应是 A. ⑤①④③ B. ⑥④③① C. ①②③⑤ D. ⑤③④① |
|
| 9. 选择题 | 详细信息 |
|
下列关于有机化合物的说法正确的是() A.乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 B.葡萄糖和果糖的分子式都是 C6H12O6,二者互为同分异构体 C.不含其他杂质的油脂属于纯净物 D.石油裂化和油脂皂化都是化学变化, 而石油的分馏和煤的干馏都是物理变化 |
|
| 10. 选择题 | 详细信息 |
|
下列关于有机物的叙述正确的是() A.1,2-二氯乙烷在 NaOH 水溶液中发生消去反应得到乙炔 B.石油液化气、汽油和石蜡的主要成分都是碳氢化合物 C.由 CH2=CH-COOCH3合成的聚合物为 D.能与NaOH溶液反应且分子式为 C2H4O2的有机物一定是乙酸 |
|
| 11. 选择题 | 详细信息 |
|
丁腈橡胶( ①CH2═CH—CH═CH2②CH3—C≡C—CH3③CH2═CH—CN④ A.②③ B.①③ C.③⑥ D.④⑤ |
|
| 12. 选择题 | 详细信息 |
|
以下说法正确的是() A.标准状况下,将22.4L二氧化硫和11.2L氧气混合在密闭容器中,在催化剂作用下加热充分反应后,生成三氧化硫分子数为NA B.l mol二氧化硅中,含有的氧原子数为2NA,含有的Si-O键为4NA C.l L 0.lmol/L的FeCl3溶液,若完全水解,则生成的Fe(OH)3胶体粒子的数目为0.lNA D.常温常压下,17g甲基(—14CH3)所含的中子数为9NA |
|
| 13. 选择题 | 详细信息 |
|
下列选项中的物质所含指定原子数目一定相等的是( ) A. 温度和压强不同,相同质量的一氧化二氮和二氧化碳两种气体的总原子数 B. 等温等压下,相同体积的乙烯和乙炔、乙烷的混合气体的总原子数 C. 等温等压下,相同体积的氧气和臭氧两种气体中的氧原子数 D. 相同物质的量、不同体积的氨气和甲烷两种气体中的氢原子数 |
|
| 14. 选择题 | 详细信息 |
|
在下列各溶液中, 离子一定能大量共存的是() A.酸性溶液中: K+、 Fe3+、Cl-、SO B.在无色透明的溶液中: K+、 Cu2+、 NO C.含有 0. l mol/L Al3+ 的溶液中 : Na+、 K+、 HCO D.室温下, pH= l 的溶液中: Na+、 Fe2+、 NO |
|
| 15. 选择题 | 详细信息 |
|
下列指定反应的离子方程式正确的是() A.向氢氧化钠溶液中通入足量的SO2气体 :2OH-+SO2=SO B.NaClO 将污水中的 NH3氧化成N2: 3ClO-+2NH3=N2↑+3Cl-+3H2O C.酸性条件下,用H2O2将Fe2+转化为Fe3+: H2O2+Fe2++2H+=Fe3++2 H2O D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO |
|
| 16. 选择题 | 详细信息 |
|
已知三个氧化还原反应: ① ② ③ 若某溶液中 A. |
|
| 17. | 详细信息 | |||||||||
|
(1)H2S中心原子的杂化类型为_________杂化 ,比较H2O 与H2S 分子的沸点, 其中沸点较高的是_____ (2)某种单质的晶体在不同温度下有两种堆积方式, 信息如下:
|
||||||||||
| 18. 填空题 | 详细信息 |
|
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。 (1)该反应氧化剂与还原剂的物质的量之比为___________。 (2)浓盐酸在反应中显示出来的性质是___________(填序号)。 A 只有还原性 B 还原性和酸性 C 只有氧化性 D 氧化性和酸性 (3)若产生0.1 mol Cl2,则转移的电子的物质的量为__________mol。 |
|
| 19. | 详细信息 |
|
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下: I.取样、氧的固定将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成 MnO(OH)2,实现氧的固定。 II.酸化将固氧后的水样酸化,MnO(OH)2 被 I- 还原为Mn2+ III.用标准 Na2S2O3溶液滴定生成的 I2(2S2O 回答下列问题: (1)写出步骤 II 的离子反应方程式___________ (2)取 100 .00mL 水样经固氧、酸化后,用 a mol•L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,滴定终点的现象是___________,且半分钟内不变色。若消耗 Na2S2O3 溶液的体积为 b mL, 则水样中溶解氧的含量为__________mg•L-1 |
|
| 20. | 详细信息 |
粘合剂 M 的合成路线如下图所示:完成下列填空: (1)写出 A 和 D 的结构简式。A______ D_____ (2)写出⑦的反应类型:_____ (3)写出②的反应条件 :_____ (4)反应③ 和 ⑤的目的是_____ (5)C 的具有相同官能团的同分异构体共有___________种(不包括C 本身) (6)写出 D 在碱性条件下水解的化学反应方程式:_____ |
|
| 21. | 详细信息 |
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: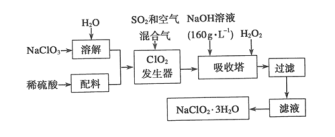 已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O; ②纯ClO2易分解爆炸, 一般用稀有气体或空气稀释到 10% 以下较安全; ③HClO2 可看成是强酸; ④ClO2常温下为气态 。 (1)160 g•L-1 NaOH溶液的物质的量浓度为______________mol•L-1,若要计算该溶液溶质的质量分数,还需要的一个条件是_______________________。 (2)在发生器中鼓入空气的作用可能是 ______________(填序号)。 A. 将 SO2氧化成SO3,增强酸性 B. 稀释 ClO2以防止爆炸 C. 将 NaClO3氧化成ClO2 (3)ClO2 发生器中发生的化学反应方程式为_____,吸收塔内的反应的离子反应方程式为_______; (4)吸收塔中为防止 NaClO2被 还原成 NaCl所用还原剂的还原性应适中。 除H2O2外,还可以选择的还原剂是_____(填序号)。 A Na2O2 B Na2S C FeCl2 D O3 |
|
最近更新



