辽宁高二化学期末考试(2018年上册)在线做题
| 1. 选择题 | 详细信息 |
|
化学与生活密切相关。下列应用中利用了物质氧化性的是( ) A. 明矾净化水 B. 纯碱去油污 C. 食醋除水垢 D. 漂白粉漂白织物 |
|
| 2. 选择题 | 详细信息 |
|
下列关于有机化合物的说法正确的是 A. 淀粉、纤维素、蔗糖水解的最终产物都相同 B. 以淀粉为原料可制取乙酸乙酯 C. 糖类物质均可直接食用并能被人体吸收 D. 油脂都不能使溴水褪色 |
|
| 3. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 最简式相同的有机物一定互为同分异构体 B. 相对分子质量相同的有机物一定互为同分异构体 C. 在分子组成上相差一个或若干个CH2原子团的有机物一定互为同系物 D. 分子组成符合CnH2n+2的通式且相对分子质量不相等的有机物一定互为同系物 |
|
| 4. 选择题 | 详细信息 |
|
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( ) A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液 C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液 |
|
| 5. 选择题 | 详细信息 |
|
下列说法中不正确的是 A. 乙醇能被酸性高锰酸钾溶液直接氧化成乙酸 B. 相同条件下的沸点顺序:戊烷>丁烷>丙烷 C. 乙烯和苯分子中所有原子均处于同一平面 D. 分子式C3H5Cl的同分异构体(包括顺反异构)有3种 |
|
| 6. 选择题 | 详细信息 |
|
下列除去杂质的方法正确的是 ①除去乙烷中少量的乙烯:催化剂,加热条件下通入氢气 ②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 ③除去溴苯中少量的溴:用氢氧化钠溶液洗涤,分液 ④除去乙醇中少量的乙酸:加足量生石灰,蒸馏 A. ①②③ B. ②③④ C. ③④ D. ①②③④ |
|
| 7. 选择题 | 详细信息 |
|
若司机酒后驾车,可通过对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O。关于该反应,下列叙述不正确的是 A. 每1 mol CrO3发生氧化反应,转移3 mol e— B. C2H5OH是还原剂 C. CrO3在反应中表现氧化性 D. C2H5OH在反应中失去电子 |
|
| 8. 选择题 | 详细信息 |
|
下列对有机物结构或性质的描述错误的是 A. 在一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 B. 乙烷和丙烯的物质的量共lmol,完全燃烧生成3mol H2O C. 光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 D. 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 |
|
| 9. 选择题 | 详细信息 |
|
某烯烃与氢气加成后得到2,2- 二甲基丁烷,则该烯烃的名称是 A. 3,3-二甲基-1-丁烯 B. 2,2-二甲基-2-丁烯 C. 2,2-二甲基-1-丁烯 D. 2,2-二甲基-3-丁烯 |
|
| 10. 选择题 | 详细信息 |
|
下列与有机物的结构、性质有关的叙述不正确的是 A. 炔烃分子不一定都处于同一直线 B. 甲苯的一氯代物有4种结构,甲苯与过量H2催化加成的最终产物,其一氯代物也有4种结构 C. 用浸泡过高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯,以达到保鲜的要求 D. 己知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
|
| 11. 选择题 | 详细信息 |
|
下列各溶液中一定能大量共存的离子组是 A. 常温下,c(H+)=10-13mol·L-1的溶液中:Na+、AlO2-、S2-、SO42- B. 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- C. 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ D. 常温下,由水电离出的c(H+)·c(OH-)=1.0×10-26mol/L的溶液中:K+ 、 Na+ 、HCO3-、Ca2+ |
|
| 12. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值,下列说法正确的是 A. 标准状况下,22.4L二氯甲烷的分子数约为NA个 B. 1.4g乙烯和丙烯混合气体中含有C-H键的数目为0.2NA C. 若将lmol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA D. 标准状况下,22.4L己烷中共价键数目为19NA |
|
| 13. 选择题 | 详细信息 |
|
下列化学用语正确的有 ①乙酸的最简式:CH2O ②聚丙烯的结构简式: ③羟基的电子式: 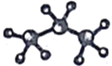 ⑤四氧化碳分子的电子式: 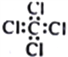 ⑥乙醇的分子式: CH3CH2OH ⑥乙醇的分子式: CH3CH2OH⑦H2CO3的电离方程式:H2CO3 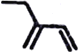 A. 1个 B. 2个 C. 3个 D. 4个 |
|
| 14. 选择题 | 详细信息 |
|
能正确表示下列反应的离子方程式是 A. 用石墨作电极电解CuCl2溶液:2Cl-+ 2H2O B. 0.01mol/L NH4A1(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O C. CaCO3溶于CH3COOH :CaCO3+2CH3COOH==Ca2++2CH3COO-+CO2↑+H2O D. Ca(HCO3)2溶液与过量NaOH 溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O |
|
| 15. 选择题 | 详细信息 |
常温下,向盛有1 L 0.1 mol·L-1NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是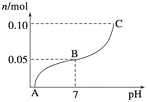 A. A点时pH=1 B. 恰好完全沉淀时Ba(OH)2的体积为2 L C. B点时,溶液中的离子浓度关系为c(Na+)>c(SO D. C点时pH=14 |
|
| 16. 选择题 | 详细信息 |
|
若现有乙酸60g、乙醇92g,如果实际产率是理论产率的67%,则得到乙酸乙酯的质量是 A. 59.0g B. 88g C. 74.8g D. 176g |
|
| 17. 选择题 | 详细信息 | ||||||||||||
根据表中信息判断,下列选项不正确的是
|
|||||||||||||
| 18. 选择题 | 详细信息 | |||||||||||||||
下列有机物命名及其一氯代物的同分异构体数目正确的是( )
|
||||||||||||||||
| 19. 选择题 | 详细信息 |
|
下列溶液中粒子的物质的量浓度关系正确的是( ) A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH) |
|
| 20. 综合题 | 详细信息 |
|
I.(1)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备ClO2,化学方程式是_____________________________________。 (2)科学家又研究出了一种新的制备ClO2方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,该反应的离子方程式为_____________________________________。 II.向50mL0.018 mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,生成沉淀。如果AgCl的Ksp=l.0×10-10,试求: (1)沉淀生成后溶液中c(Ag+)为_____________________。 (2)沉淀生成后溶液的pH是_____________________。 |
|
| 21. 综合题 | 详细信息 |
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示;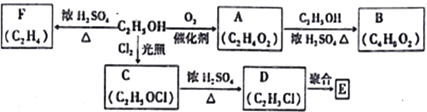 回答下列问题: (1)A的结构简式为_____________________。 (2)由乙醇生产C的化学反应类型为_____________________。 (3)E是一种常见的塑料,其化学名称是_____________________。 (4)由乙醇生成F的化学方程式为__________________________________。 (5)写出A生成B的化学方程式____________________________________。 |
|
| 22. 实验题 | 详细信息 |
|
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x 值,进行如下实验: ①称取wg草酸晶体,配成100.00 mL水溶液。 ②量取25.00 mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。 ③用浓度为a mol/L的KMnO4溶液滴定到终点。 所发生的反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O 。试回答: (1)实验中不需要的仪器有___________(填序号),还缺少的玻璃仪器有________(填名称)。 a.托盘天平(带砝码,镊子) b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶 (2)实验中,标准液KMnO4溶液应装在_____________式滴定管中。 (3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会____________(填“偏大”、“ 偏小”、“ 无影响”) (4)滴定时,根据_______________现象,即可确定反应达到终点。 (5)在滴定过程中若用amol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_______mol/L,由此可计算x的值是____________。 |
|
| 23. 填空题 | 详细信息 | ||||||||
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
|
|||||||||



