ж№–еҢ—зңҒеҚҒе °еёӮ2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ғзҙ дёӯз”өиҙҹжҖ§жңҖеӨ§зҡ„жҳҜ A.O B.F C.S D.Cl |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҷ¶дҪ“дёӯеұһдәҺеҺҹеӯҗжҷ¶дҪ“зҡ„жҳҜ A.I2 B.SiC C.Cu D.CsCl |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
й“ҒеҺҹеӯҗж ёеӨ–з”өеӯҗеҚ жҚ®зҡ„жңҖй«ҳиғҪзә§жҳҜ A.3s B.3p C.3d D.4s |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҲҶеӯҗзҡ„дёӯеҝғеҺҹеӯҗжқӮеҢ–иҪЁйҒ“зұ»еһӢдёә sp3зҡ„жҳҜ A.SO2 B.H2S C.CS2 D.BF3 |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ A.SiO2жҳҜзӣҙзәҝеҪўеҲҶеӯҗ B.Na2O2еҗ«жңүйқһжһҒжҖ§й”® C.MgCl2еҸӘеҗ«жңүзҰ»еӯҗй”® D.H2O еҲҶеӯҗе‘Ҳ V еҪў |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еӨ§е°Ҹе…ізі»еҸҜз”Ёж°ўй”®и§ЈйҮҠзҡ„жҳҜ A.зҶ”зӮ№пјҡC4H10пјһCH4 B.зғӯзЁіе®ҡжҖ§пјҡNH3пјһPH3 C.жІёзӮ№пјҡH2OпјһH2S D.й”®иғҪпјҡHFпјһHCl |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯиЎЁиҫҫжӯЈзЎ®зҡ„жҳҜ A.ж°ҹеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸпјҡ1s22s22p5 B.зЎјеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғеӣҫпјҡ C.зЎ«зҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ  D.Na2O зҡ„з”өеӯҗејҸпјҡ |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
ж №жҚ®иЎЁдёӯж•°жҚ®пјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ
|
|||||||||||||||||||
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
жҹҗдәӣжҷ¶дҪ“жҲ–жҷ¶иғһз»“жһ„зӨәж„ҸеӣҫеҰӮдёӢгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ  A.еӣҫ 1 жүҖзӨәйҮ‘еҲҡзҹіжҷ¶дҪ“дёӯпјҢзўіеҺҹеӯҗдёҺзўізўій”®дёӘж•°жҜ”дёә 1:4 B.еӣҫ 2 жүҖзӨә CsCl жҷ¶иғһдёӯпјҢCs+зҡ„й…ҚдҪҚж•°дёә 6 C.еӣҫ 3 жүҖзӨә CaF2жҷ¶иғһдёӯпјҢеҗ«жңү 4 дёӘ Ca2+ D.еӣҫ 4 жүҖзӨәе№ІеҶ°жҷ¶дҪ“дёӯ1дёӘ CO2еҲҶеӯҗе‘Ёеӣҙзҙ§йӮ» 8 дёӘ CO2еҲҶеӯҗ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒW еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮX зҡ„з®ҖеҚ•ж°ўеҢ–зү©е’Ңе…¶жңҖй«ҳд»·еҗ«ж°§й…ёеҸҜеҪўжҲҗзӣҗпјҢY дёҺ X еҗҢе‘Ёжңҹдё”жҳҜиҜҘе‘Ёжңҹдё»ж—Ҹе…ғзҙ дёӯеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„е…ғзҙ пјӣW-е…·жңүдёҺж°©еҺҹеӯҗзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„пјӣZгҖҒW еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’Ңдёә 8.дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A.X дёҺ Z зҡ„з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„пјҡX>Z B.Z зҡ„еҚ•иҙЁеҸҜдёҺ O2еҪўжҲҗдёӨз§ҚеҢ–еҗҲзү© C.W зҡ„ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©еқҮдёәејәй…ё D.Y дёҺ Z еҪўжҲҗзҡ„еҢ–еҗҲзү©ж°ҙжә¶ж¶ІжҳҫзўұжҖ§ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҜ№еҸӨиҜ—ж–Үж¶үеҸҠзҡ„еҢ–еӯҰзҹҘиҜҶзҗҶи§Јй”ҷиҜҜзҡ„жҳҜ A.вҖңдёңйЈҺеӨңж”ҫиҠұеҚғж ‘пјҢжӣҙеҗ№иҗҪпјҢжҳҹеҰӮйӣЁвҖқдёӯзҮғж”ҫзғҹиҠұж¶үеҸҠеҢ–еӯҰеҸҚеә” B.вҖңеҸҲеҚ—дёүзҷҫйҮҢпјҢж—ҘиҖҝеұұпјҢж— иҚүжңЁпјҢеӨҡж°ҙзў§вҖқдёӯзҡ„ж°ҙзў§(ж°ҙжҷ¶)жҳҜеҺҹеӯҗжҷ¶дҪ“ C.вҖңж¬ІжёЎй»„жІіеҶ°еЎһе·қпјҢе°Ҷзҷ»еӨӘиЎҢйӣӘж»ЎеұұвҖқдёӯжҸҸиҝ°зҡ„й»„жІіж°ҙз»“еҶ°жҳҜеҗёзғӯеҸҚеә” D.вҖңй”ҷжҠҠйҷҲйҶӢеҪ“жҲҗеўЁпјҢеҶҷе°ҪеҚҠз”ҹзәёдёҠй…ёвҖқдёӯйҷҲйҶӢйҮҢзҡ„йҶӢй…ёжҳҜејұз”өи§ЈиҙЁ |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№е·Із»ҸиҫҫеҲ°е№іиЎЎзҡ„еҸҚеә” A.йҖҶеҸҚеә”йҖҹзҺҮеўһеӨ§пјҢжӯЈеҸҚеә”йҖҹзҺҮеҮҸе°ҸпјҢе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ B.йҖҶеҸҚеә”йҖҹзҺҮеҮҸе°ҸпјҢжӯЈеҸҚеә”йҖҹзҺҮеўһеӨ§пјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ C.жӯЈгҖҒйҖҶеҸҚеә”йҖҹзҺҮйғҪеҮҸе°ҸпјҢе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ D.жӯЈгҖҒйҖҶеҸҚеә”йҖҹзҺҮйғҪеўһеӨ§пјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁдёӢеҲ—д»ӘеҷЁжҲ–иЈ…зҪ®(еӨ№жҢҒиЈ…зҪ®з•Ҙ)иҝӣиЎҢе®һйӘҢпјҢиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜ A.иҜҒжҳҺйҶӢй…ёдёәејұй…ё  B.еҲ¶еӨҮж°ўж°§еҢ–й“Ғиғ¶дҪ“ B.еҲ¶еӨҮж°ўж°§еҢ–й“Ғиғ¶дҪ“ C.дёӯе’Ңзғӯзҡ„жөӢе®ҡ  D.й…ёзўұдёӯе’Ңж»ҙе®ҡ D.й…ёзўұдёӯе’Ңж»ҙе®ҡ |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еёёжё©дёӢпјҢN2е’Ң O2еҸҚеә”з”ҹжҲҗ NO зҡ„иғҪйҮҸеҸҳеҢ–еҰӮдёӢеӣҫгҖӮдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ  A. B. C. D. |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҗ‘дҪ“з§Ҝдёә 10 L зҡ„жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯйҖҡе…Ҙ 1.5 mol CH4(g)е’Ң 1.5 mol H2O(g)пјҢеҸ‘з”ҹеҸҚеә”CH4(g)пјӢH2O(g)  A.Ta<Tb B.иҜҘеҸҚеә”жҳҜж”ҫзғӯеҸҚеә” C.Tbж—¶пјҢCH4зҡ„е№іиЎЎиҪ¬еҢ–зҺҮжҳҜ 60% D.Taж—¶пјҢе№іиЎЎеҗҺдҪ“зі»зҡ„еҺӢејәдёәиө·е§ӢеҺӢејәзҡ„ |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—е…ідәҺ pH=10 зҡ„ Na2CO3жә¶ж¶ІиҜҙжі•й”ҷиҜҜзҡ„жҳҜ A.ж°ҙз”өзҰ»зҡ„ c(OH-)=1Г—10-4 molВ·L-1 B.иӢҘеҚҮй«ҳжё©еәҰпјҢжә¶ж¶Ідёӯ c(OH-)еўһеӨ§ C.иӢҘеҠ е…Ҙе°‘йҮҸ NaOH еӣәдҪ“пјҢжә¶ж¶Ідёӯc( D.жә¶ж¶Ідёӯпјҡ |
|
| 17. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
0.02 molВ·L-1 HCN дёҺ 0.01 molВ·L-1 NaOH зӯүдҪ“з§Ҝж··еҗҲпјҢжөӢеҫ—c(Na+)пјһc(CN-)гҖӮдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜ A.c(H+)пјһc(OH-) B.c(HCN)пјһc(Na+) C.c(H+)+c(HCN)=c(OH-) D.c(HCN)+c(CN-)=0.02 molВ·L-1 |
|
| 18. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҗҲжҲҗд№ҷзғҜзҡ„еҸҚеә”дёә 6H2(g)пјӢ2CO2(g)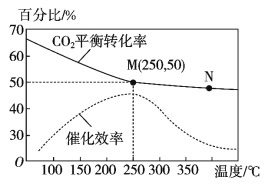 A.еҢ–еӯҰе№іиЎЎеёёж•°пјҡKMпјһKN B.з”ҹжҲҗд№ҷзғҜзҡ„йҖҹзҺҮпјҡv(M)дёҖе®ҡе°ҸдәҺ v(N) C.250 в„ғе·ҰеҸіпјҢеӮ¬еҢ–еүӮзҡ„еӮ¬еҢ–ж•ҲзҺҮжңҖй«ҳ D.M зӮ№пјҢд№ҷзғҜзҡ„дҪ“з§ҜеҲҶж•°зәҰдёә 7.7% |
|
| 19. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢжүҖж¶үеҸҠеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ A.еҗ‘ FeCl3жә¶ж¶Ідёӯж»ҙе…Ҙ KSCN жә¶ж¶Іпјҡ B.еҗ‘зЎ«й…ёй“қжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡ C.еҗ‘ KI жә¶ж¶Ідёӯж»ҙеҠ зЎ«й…ёй…ёеҢ–зҡ„иҝҮж°§еҢ–ж°ўжә¶ж¶Іпјҡ D.еҗ‘иҚүй…ёжә¶ж¶Ідёӯж»ҙеҠ й…ёжҖ§KMnO4жә¶ж¶Іпјҡ |
|
| 20. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
t в„ғж—¶пјҢAgCl зҡ„ Ksp=1.8Г—10-10пјҢAg2CrO4(ж©ҳзәўиүІ)еңЁж°ҙжә¶ж¶Ідёӯзҡ„жІүж·Җжә¶и§Је№іиЎЎжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ 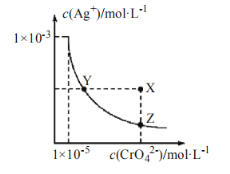 A.t в„ғж—¶пјҢAg2CrO4зҡ„ Kspдёә 1Г—10-8 B.t в„ғж—¶пјҢY зӮ№е’Ң Z зӮ№зҡ„ Kspзӣёзӯү C.йҘұе’Ң Ag2CrO4жә¶ж¶ІдёӯеҠ е…Ҙ K2CrO4еҸҜдҪҝеӣҫдёӯ Y зӮ№з§»еҠЁеҲ° X зӮ№ D.t в„ғж—¶пјҢе°Ҷ 0.01 molВ·L-1 AgNO3жә¶ж¶Іж»ҙе…Ҙ 20 mL 0.01 molВ·L-1 KCl е’Ң 0.01 molВ·L-1 K2CrO4зҡ„ж··еҗҲжә¶ж¶ІдёӯпјҢе…ҲеҮәзҺ°ж©ҳзәўиүІжІүж·Җ |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
жҺәжқӮ Ni2+зҡ„ KZnF3зәізұіеӨҚеҗҲзҺ»з’ғйҷ¶з“·иғҪеӨҹиҺ·еҫ—и¶…е®ҪеёҰеҸ‘е…үпјҢжҲҗдёәж–°еһӢеҸ‘е…үзҺ»з’ғйҷ¶з“·гҖӮKZnF3еҸҜз”ұ K2CO3гҖҒZnF2гҖҒNH4HF2еҲ¶еӨҮгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)N е…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®___________пјҢдҪҚдәҺе‘ЁжңҹиЎЁ___________еҢәгҖӮ (2)Ni2+иғҪдёҺ NH3еҪўжҲҗй…ҚзҰ»еӯҗ[Ni(NH3)6]2+пјҢNH3зҡ„з©әй—ҙжһ„еһӢжҳҜ___________пјҢдёҺ NH3дә’дёәзӯүз”өеӯҗдҪ“зҡ„йҳізҰ»еӯҗжҳҜ___________гҖӮ (3)еҹәжҖҒ Ni еҺҹеӯҗзҡ„еӨ–еӣҙз”өеӯҗжҺ’еёғејҸдёә___________пјӣе…¶ж ёеӨ–з”өеӯҗеҚ жҚ®зҡ„жңҖй«ҳиғҪеұӮз¬ҰеҸ·дёә___________гҖӮ (4)KZnF3дёӯ K дёҺ Zn еұһдәҺеҗҢдёҖе‘ЁжңҹпјҢ第дёҖз”өзҰ»иғҪ K___________Zn(еЎ«вҖңеӨ§дәҺвҖқжҲ–вҖңе°ҸдәҺвҖқ)пјҢеҺҹеӣ жҳҜ___________гҖӮ (5)еҰӮеӣҫдёә KZnF3зҡ„жҷ¶иғһз»“жһ„зӨәж„ҸеӣҫгҖӮ KZnF3жҷ¶иғһдёӯеҺҹеӯҗеқҗж ҮеҸӮж•° A дёә(0пјҢ0пјҢ0)пјӣ B дёә(1пјҢ0пјҢ0)пјӣC дёә(0пјҢ1пјҢ0)пјҢеҲҷ D зҡ„еҺҹеӯҗеқҗж ҮеҸӮж•°дёә___________гҖӮ 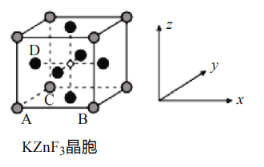 |
|
| 22. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жұҪиҪҰе°ҫж°”дёӯзҡ„ж°®ж°§еҢ–зү©жҳҜеҹҺеёӮз©әж°”зҡ„дё»иҰҒжұЎжҹ“зү©д№ӢдёҖпјҢеҰӮдҪ•йҷҚдҪҺжұҪиҪҰе°ҫж°”жұЎжҹ“е·ІжҲҗдёәзҺҜдҝқйўҶеҹҹзҡ„зғӯзӮ№гҖӮ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)科жҠҖе·ҘдҪңиҖ…з”Ёз”Ізғ·е°Ҷж°®ж°§еҢ–зү©иҝҳеҺҹдёә N2е’Ң H2OпјҢж¶үеҸҠзҡ„еҸҚеә”еҰӮдёӢпјҡ CH4(g)пјӢ4NO2(g) =4NO(g)пјӢCO2(g)пјӢ2H2O(g) О”H1=-574 kJ/mol CH4(g)пјӢ2NO2(g) =CO2(g)пјӢ2H2O(g)пјӢN2(g) О”H2=-867 kJ/mol еҲҷ CH4(g)иҝҳеҺҹ NO(g)з”ҹжҲҗ N2(g)зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёә___________гҖӮ (2)дҪҝз”Ёж°ўиғҪжәҗеҸҜд»ҘеҮҸе°‘жұҪиҪҰе°ҫж°”дёӯжңүе®іж°”дҪ“зҡ„жҺ’ж”ҫгҖӮеҲ©з”Ёз”ІйҶҮдёҺж°ҙи’ёж°”еҸҚеә”еҸҜд»ҘеҲ¶еӨҮж°ўж°”пјҡCH3OH(g)пјӢH2O(g) =CO2(g)пјӢ3H2(g) О”HпјҢиҜҘеҸҚеә”иҝҮзЁӢдёӯзҡ„иғҪйҮҸеҸҳеҢ–еҰӮеӣҫпјҡ  в‘ О”H___________0(еЎ«вҖң>вҖқвҖң=вҖқжҲ–вҖңпјңвҖқ)гҖӮ в‘ЎйҖ”еҫ„(в… )зҡ„жҙ»еҢ–иғҪ E=___________гҖӮ в‘ўйҖ”еҫ„(в… )еҸҳдёәйҖ”еҫ„(в…Ў)пјҡж”№еҸҳзҡ„жқЎд»¶жҳҜ___________пјҢеҸҚеә”зғӯ(О”H)___________(еЎ«вҖңеўһеӨ§вҖқвҖңеҮҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ |
|
| 23. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҷзғҜжҳҜйҮҚиҰҒзҡ„жңүжңәеҢ–е·ҘеҺҹж–ҷпјҢдёҷзғ·и„ұж°ўеҲ¶дёҷзғҜе…·жңүжҳҫи‘—зҡ„з»ҸжөҺд»·еҖје’ҢзӨҫдјҡж„Ҹд№үгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еңЁдёҖе®ҡжё©еәҰдёӢпјҢеҗ‘ 1 L жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ 1 mol C3H8(g)пјҢеҸ‘з”ҹеҸҚеә”пјҡC3H8(g) в‘ дёӢеҲ—иғҪиҜҙжҳҺдёҠиҝ°еҸҚеә”дёҖе®ҡиҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„жҳҜ___________(еЎ«еӯ—жҜҚж ҮеҸ·)гҖӮ AпјҺn(C3H6):n(H2)=1:1 BпјҺж°”дҪ“е№іеқҮж‘©е°”иҙЁйҮҸдҝқжҢҒдёҚеҸҳ CпјҺж°”дҪ“еҜҶеәҰдҝқжҢҒдёҚеҸҳ DпјҺC3H8еҲҶи§ЈйҖҹзҺҮдёҺ C3H6ж¶ҲиҖ—йҖҹзҺҮзӣёзӯү в‘Ўж¬ІдҪҝдёҷзғҜзҡ„е№іиЎЎдә§зҺҮжҸҗй«ҳпјҢеә”йҮҮеҸ–зҡ„жҺӘж–ҪжҳҜ___________(еЎ«еӯ—жҜҚж ҮеҸ·)гҖӮ AпјҺеҚҮй«ҳжё©еәҰ BпјҺйҷҚдҪҺжё©еәҰ CпјҺеҠ еӮ¬еҢ–еүӮ DпјҺе……е…Ҙ C3H8 в‘ўз»ҸиҝҮ 4 minпјҢеҸҚеә”иҫҫеҲ°е№іиЎЎпјҢжӯӨж—¶е®№еҷЁеҺӢејәдёә 1.4 p0 MPaпјҢеҲҷеүҚ 4 min зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮ v(H2)=___________пјҢиҜҘжё©еәҰдёӢеҸҚеә”зҡ„е№іиЎЎеёёж•° K=___________molВ·L-1. (2)жҹҗз§‘з ”жңәжһ„еҲ©з”Ё CO2зҡ„ејұж°§еҢ–жҖ§ејҖеҸ‘дәҶдёҷзғ·ж°§еҢ–и„ұж°ўеҲ¶дёҷзғҜзҡ„ж–°е·ҘиүәпјҢиҜҘе·ҘиүәйҮҮ用铬зҡ„ж°§еҢ–зү©дҪңеӮ¬еҢ–еүӮпјҢе…¶еҸҚеә”жңәзҗҶеҰӮеӣҫгҖӮ  еӣҫдёӯвҖң(i)вҖқзҡ„еҢ–еӯҰж–№зЁӢејҸдёә___________гҖӮиҜҘе·ҘиүәйҮҮз”Ёзҡ„еӮ¬еҢ–еүӮдёә___________гҖӮ |
|
| 24. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
зЈ·е…ғзҙ иғҪеҪўжҲҗеӨҡз§Қеҗ«ж°§й…ёгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)ж¬ЎзЈ·й…ё(H3PO2)жҳҜдёҖе…ғејұй…ёпјҢе…¶еңЁж°ҙжә¶ж¶Ідёӯзҡ„з”өзҰ»ж–№зЁӢејҸдёә___________гҖӮ (2)дәҡзЈ·й…ё(H3PO3)жҳҜдәҢе…ғејұй…ёгҖӮе·ІзҹҘ 25 в„ғж—¶пјҢKa1=1Г—10-2пјҢKa2=2.6Г—10-7. в‘ Na2HPO3еұһдәҺ___________(еЎ«вҖңй…ёејҸзӣҗвҖқжҲ–вҖңжӯЈзӣҗвҖқ)пјӣNaH2PO3жә¶ж¶Іжҳҫ___________(еЎ«вҖңй…ёжҖ§вҖқвҖңзўұжҖ§вҖқжҲ–вҖңдёӯжҖ§вҖқ)гҖӮ в‘Ўе·ІзҹҘ 25в„ғж—¶пјҢCH3COOH зҡ„ Ka=1.75Г—10-5пјҢеҲҷ CH3COOH жә¶ж¶Іе’Ң Na2HPO3жә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә___________гҖӮ (3)жөӢе®ҡдәҡзЈ·й…ёжә¶ж¶Ізҡ„жө“еәҰгҖӮ еҸ– 25.00 mL дәҡзЈ·й…ёжә¶ж¶Іж”ҫе…Ҙй”ҘеҪўз“¶дёӯпјҢз”Ё 0.10 molВ·L-1й…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиҝӣиЎҢж»ҙе®ҡпјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә иҝӣиЎҢдёүж¬Ўе®һйӘҢпјҢи®°еҪ•ж•°жҚ®еҰӮдёӢиЎЁпјҡ
в‘ ж»ҙе®ҡз»ҲзӮ№зҡ„зҺ°иұЎжҳҜ___________гҖӮ |
|||||||||||||
| 25. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
й•ҚеӮ¬еҢ–еүӮзҡ„дё»иҰҒжҲҗеҲҶдёә NiпјҢиҝҳеҗ«жңүдёҖе®ҡйҮҸ AlгҖҒFe еҸҠж°§еҢ–й“ҒгҖҒе°‘йҮҸе…¶д»–дёҚжә¶жҖ§зү©иҙЁпјҢеӣһ收еәҹй•ҚеӮ¬еҢ–еүӮеҲ¶еӨҮзЎ«й…ёй•Қжҷ¶дҪ“(NiSO4В·7H2O)зҡ„е·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ 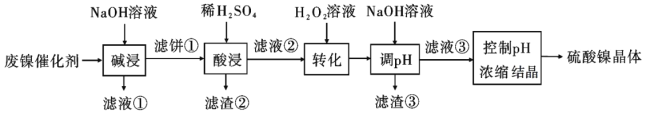 жә¶ж¶ІдёӯйҮ‘еұһзҰ»еӯҗејҖе§ӢжІүж·Җе’Ңе®Ңе…ЁжІүж·Җзҡ„ pH еҰӮдёӢиЎЁжүҖзӨәпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ |
|||||||||||||
- жҰ•жұҹеҺҝ第дёүй«ҳзә§дёӯеӯҰй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•йўҳе…Қиҙ№иҜ•еҚ·
- 2018-2019е№ҙй«ҳдёҖдёҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲж–°з–ҶзҹіжІіеӯҗеёӮе…өеӣўе…«еёҲдёҖеӣӣдёүеӣўз¬¬дёҖдёӯеӯҰпјү
- иӢҸе·һеёӮ2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еңЁзәҝеҒҡйўҳ
- жІіеҢ—й«ҳдёүеҢ–еӯҰ2019е№ҙеҗҺеҚҠжңҹй«ҳиҖғжЁЎжӢҹиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- дёүдәҡеҚҺдҫЁеӯҰж ЎпјҲеҚ—ж–°ж ЎеҢәпјүе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2019пјҲдё“йўҳ8 第дёҖеҚ•е…ғ 第3иҜҫж—¶ з…Өзҡ„з»јеҗҲеҲ©з”Ё иӢҜ-й«ҳдёӯеҢ–еӯҰеҝ…дҝ®з¬¬дәҢеҶҢиӢҸж•ҷзүҲпјү
- 2018~2019е№ҙй«ҳдёҖдёӢеҶҢ第дәҢж¬Ўж®өиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲе№ҝдёңзңҒдёӯеұұеёӮзәӘеҝөдёӯеӯҰпјү
- йҳңйҳіеёӮй«ҳдёҖеҢ–еӯҰ2019е№ҙдёӢеҚҠжңҹжңҹжң«иҖғиҜ•е®Ңж•ҙиҜ•еҚ·



