海南华侨中学观澜湖学校2020届高三上期第一次月考化学题免费试卷在线检测
| 1. 选择题 | 详细信息 |
|
下列说法正确的是 A.摩尔是基本物理量之一 B.1 mol H2O所含氧的质量为16 g C.10 L H2比8 L H2所含H2的物质的量更多 D.某物质含有6.02×1023个粒子,那么此物质所占的体积为22.4 L |
|
| 2. 选择题 | 详细信息 |
|
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( ) ①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ③转移溶液前容量瓶内有少量蒸馏水 ④定容时,俯视容量瓶的刻度线 ⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ②③④ |
|
| 3. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.分子数为NA的CO和C2H4混合气体的体积约为22.4 L B.标准状况下,4.48 L重水(D2O)中含有的中子数为2NA C.用MnO2与浓盐酸制取Cl2时,每生成0.5mol Cl2则转移电子数为NA D.0.1 L 3.0 mol·L-1的NH4NO3溶液中含有NH4+的数目为0.3NA |
|
| 4. 选择题 | 详细信息 | ||||||||||||
pH=12的某溶液中有关数据如下:
|
|||||||||||||
| 5. 选择题 | 详细信息 |
|
常温下列各组离子在指定溶液中能大量共存的是( ) A.无色透明的溶液中:Fe3+、Mg2+、SCN—、Cl— B.常温下,pH>7的溶液中:K+、Na+、CO C.c(Fe2+)=1 mol•L—1的溶液中:K+、NH D.能使甲基橙变红的溶液中:Na+、NH |
|
| 6. 选择题 | 详细信息 |
|
硫酸亚铁铵受热分解的反应方程式为 A.1 L 0.1 mol·L−1 B.将1 mol C.标准状况下,每生成22.4.L N2转移电子数目为3 D.常温常压下,3.0 g |
|
| 7. 选择题 | 详细信息 |
|
下列各组离子在相应的条件下可能大量共存的是( ) A.能使pH试纸变蓝的溶液中:CO B.由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO C.在 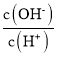 =1×1012的溶液中:NH =1×1012的溶液中:NHD. |
|
| 8. 选择题 | 详细信息 | ||||||||||||
下列实验操作或装置能达到目的的是( )
|
|||||||||||||
| 9. 选择题 | 详细信息 |
|
用NaBH4与FeCl3反应可制取纳米铁: A.NaBH4的电子式为  B.该反应中氧化剂只有FeCl3 C.NaBH4与稀硫酸不发生反应 D.该反应中每生成1mol Fe,转移的电子数为3mol |
|
| 10. 选择题 | 详细信息 |
|
下列指定反应的离子方程式正确的是( ) A.二氧化硫通入次氯酸钠溶液:SO2 + ClO-+ 2OH-=SO B.金属铝溶于稀硫酸中:Al + 2H+ =A13+ + H2↑ C.向NaClO溶液中通入足量CO2:ClO-+CO2+H2O=HClO+HCO D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
|
| 11. 选择题 | 详细信息 |
用“银-Ferrozine”法测室内甲醛含量的原理为: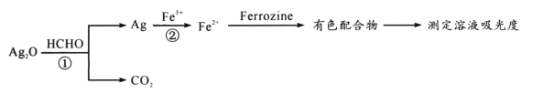 已知:吸光度与溶液中有色物质的浓度成正比 下列说法正确的是 A. 反应①中参与反应的HCHO为30g时转移电子2mol B. 可用双氧水检验反应②后的溶液中是否存在Fe3+ C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol D. 理论上测得溶液吸光度越高,HCHO含量也越高 |
|
| 12. 填空题 | 详细信息 |
|
实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓) (1)氧化剂是___________; 氧化产物是___________ ; (2)如果有8.7g纯MnO2被还原,那么:被氧化的氯化氢的质量为___________;转移电子的物质的量为___________。 (3)纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4,氯变为-1价。写出该过程的化学方程式 ___________ |
|
| 13. 填空题 | 详细信息 |
|
(1)有下列物质;①盐酸 ②NaOH ③氯气 ④硫酸钡 ⑤蔗糖 ⑥铜 ⑦醋酸 ⑧熔融的NaCl ⑨CO2 属于电解质的为___________,非电解质的为___________(填序号,下同),属于强电解质的为___________,能导电的是___________。 (2)下列数量的各物质所含原子数按由大到小的顺序排列是___________。 ①0.5 mol氨气 ②标准状况下22.4 L氦气 ③0.2 mol磷酸钠(Na3PO4) |
|
| 14. 填空题 | 详细信息 |
|
某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。 (1)KClO4是助氧化剂,含有化学键的类型为___________;其中Cl的化合价是___________。 (2)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为___________。 (3)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为___________(填化学式)。 (4)NaN3是气体发生剂,受热分解产生N2和Na。取130 g上述产气药剂,分解产生的气体通过碱石灰后的体积为33.6 L(标准状况),该产气药剂中NaN3的质量分数为___________。 |
|
| 15. 填空题 | 详细信息 |
|
(1)已知:+5价钒在溶液中存在如下平衡: (2)①Cl2可用于制备新型净水剂高铁酸钠(Na2FeO4),配平化学方程式____,_____Fe(NO3)3+_____NaOH+_____Cl2→_____Na2FeO4+_____NaNO3+_____NaCl+_____H2O ②若反应消耗3.36L Cl2(标准状况),则转移电子的数目是___________。 ③用Na2FeO4杀菌消毒的优点是还原产物具有净水作用,缺点是还原产物会对铁制水管造成腐蚀,造成腐蚀的原理有___________。 |
|
| 16. 实验题 | 详细信息 |
|
(1)在Fe(OH)3胶体中,逐滴加入稀盐酸,会出现一系列变化。 先出现红褐色沉淀,原因是___________;随后沉淀溶解,该过程的化学方程式是___________。 (2)二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题: ①在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:___________。 ②某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。 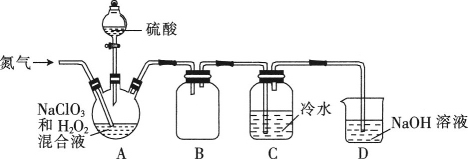 a.通入氮气的主要作用有2个,一是可以起到搅拌作用,二是___________。 b.装置B的作用是___________。 c.装置A用于生成ClO2气体,该反应的化学方程式为___________。 |
|
| 17. | 详细信息 |
钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示 (1)Na2MoO4•2H2O中钼元素的化合价为___________。 (2)焙烧时为了使钼精矿充分反应,可采取的措施是___________(答出一条即可)。 (3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 (4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________。 |
|
最近更新







