2019-2020年高一下学期第三次月考化学题免费试卷(四川省江油中学)
| 1. 选择题 | 详细信息 |
|
某有机物含有C、H、O、N等元素,属于高分子化合物,则该有机物可能是( ) A.氨基酸 B.淀粉 C.蛋白质 D.脂肪 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是 A.只含有一种元素的物质一定是纯净物 B.含有共价键的化合物一定是共价化合物 C.石墨转变为金刚石为化学变化 D.水很稳定是因为水分子间存在较强的分子间作用力 |
|
| 3. 选择题 | 详细信息 |
|
下列化学用语表达正确的是( ) A.过氧化氢的电子式:H+ [ C.次氯酸的电子式 H∶  |
|
| 4. 选择题 | 详细信息 |
|
下列反应中,既属于氧化还原反应,又属于吸热反应的是( ) A. 灼热的炭与水蒸气的反应 B. 锌片与稀硫酸的反应 C. 甲烷在空气中的燃烧反应 D. Ba(OH)2 ·8H2O与NH4Cl的反应 |
|
| 5. 选择题 | 详细信息 |
|
常温避光条件下,下列各组气体能稳定共存的是( ) A.CH4 Cl2 H2 B.NO CO2 O2 C.NH3 N2 HCl D.H2S O2 SO2 |
|
| 6. 选择题 | 详细信息 |
|
下列反应原理不符合工业冶炼金属实际情况的是( ) A. C. |
|
| 7. 选择题 | 详细信息 |
|
下列物质一定属于纯净物的是 A. 冰醋酸 B. 铝热剂 C. 聚乙烯 D. C4H10 |
|
| 8. 选择题 | 详细信息 |
|
根据元素周期表和元素周期律分析下面的推断,其中错误的是( ) A.铍(Be)的单质比金属镁与盐酸反应剧烈 B.铋(Bi)的氢化物不稳定 C.氢氧化锶 [ Sr(OH)2 ] 比氢氧化钙的碱性强 D.硼(B)的原子失电子能力比铝弱 |
|
| 9. 选择题 | 详细信息 |
|
可逆反应H2(g)+I2(g) A.混合气体的颜色不再改变 B.H2、I2、HI的浓度相等 C.混合气体的密度保持不变 D.H2、I2、HI分子个数比为1:1:2 |
|
| 10. 选择题 | 详细信息 |
|
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y是同周期金属性最强的元素,Z的单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是 A.原子半径大小顺序:r(W)>r(Y)>r(X) B.非金属性强弱顺序:X>W>Z C.最高价氧化物对应水化物的酸性:Z>W D.化合物Y2X、ZX2、WX3中化学键类型相同 |
|
| 11. 选择题 | 详细信息 |
|
短周期元素的离子aA3+、bB+、cC2-、dD-具有相同的电子层结构,下列关系式正确的是( ) A.a>b>c>d B.a+c=b+d C.氢化物的稳定性:H2C>HD D.碱性:A(OH)3<BOH |
|
| 12. 选择题 | 详细信息 |
|
设阿伏加德罗常数的值为NA,下列说法正确的是( ) A.标准状况下,2.24LCHCl3所含氯原子数目为0.3NA B.14g乙烯与丙烯的混合气体中含氢原子数目为2NA C.1 mol羟基(-OH)中所含电子数目为10NA D.1.8 g D2O含有的质子数和中子数均为0.1NA |
|
| 13. 选择题 | 详细信息 |
|
下列关于有机物的叙述正确的是( ) A.乙醇中的少量乙酸可用饱和Na2CO3溶液除去 B.用水鉴别苯、乙醇、硝基苯 C.乙烯、聚乙烯和苯都能使溴的CCl4溶液褪色 D.用KI淀粉溶液鉴别NO2气体和Br2蒸气 |
|
| 14. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验的现象与对应结论均正确的是( )
|
|||||||||||||||||||||
| 15. 选择题 | 详细信息 |
海洋中有丰富的资源,按下图所示工艺流程可利用海水获得Br2: 下列描述不正确的是( ) A.从海水中提取溴,一般要经历浓缩、氧化、还原富集和再氧化等步骤 B.利用溴的挥发性,鼓入热空气或水蒸气,就可将溴吹出来 C.第②步发生反应的离子方程式为:SO2+Br2+2H2O==4H++2Br-+ D.要除去产品溴中的少量氯气,可依次加入NaOH溶液及苯 |
|
| 16. 选择题 | 详细信息 |
|
105 ℃、101 kPa时,甲烷、乙烷和乙烯组成的混合烃80 mL与过量O2混合并完全燃烧,恢复到原来的温度和压强,混合气体总体积增加了30 mL。原混合烃中乙烷的体积分数为 A. 12.5% B. 25% C. 50% D. 75% |
|
| 17. 选择题 | 详细信息 |
|
将一定量的Fe、FeO和Fe2O3混合物投入到150 mL 2 mol·L-1的HNO3溶液中,恰好使混合物完全溶解,并生成1.12 L NO气体(标准状况),在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( ) A.7 g B.14 g C.28 g D.无法计算 |
|
| 18. 填空题 | 详细信息 |
|
(1)下列五种物质中含有共价键的物质有______(填序号)。 ①单质氖 ②硫化氢 ③二氧化硅 ④氯化钙 ⑤硝酸钾 (2)请用下列物质转化或分离方法的序号填空(每一项只填写一种方法)。 ①裂解 ②分馏 ③裂化 ④干馏 ⑤蒸馏 ⑥电解 把煤转化为焦炉气、煤焦油等:___,从原油中分离出汽油、煤油、柴油等:____, 将重油转化为乙烯等化工原料:___,用海水中得到的无水MgCl2制取金属镁:__。 |
|
| 19. | 详细信息 |
A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25 g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):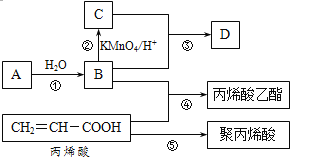 (1)A的电子式为___________,C中官能团的名称为__________。 (2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。 a.加成反应 b.取代反应 c.加聚反应 d.中和反应 e.氧化反应 (3)用两种方法鉴别B和C,所用试剂分别是___________、___________。 (4)丙烯酸乙酯的结构简式为____________。 (5)写出下列反应方程式和有机反应基本类型: ①____________________________,_________反应; ⑤ ___________________________,_________反应。 |
|
| 20. 计算题 | 详细信息 |
|
向一个容积为5 L的密闭容器中充入6 mol H2和2 mol CO,在恒温和催化剂作用下发生反应:2H2(g)+CO(g) (1)反应开始至平衡时,以H2的浓度变化表示该反应的平均速率v(H2)=__________。 (2)起始状态与平衡状态容器内的压强之比为______。 |
|
最近更新



