2017-2018年高二12月月考化学考卷带参考答案和解析(安徽省铜陵市第一中学)
| 1. 选择题 | 详细信息 |
|
能证明乙酸是弱酸的实验事实是( ) A. CH3COOH溶液与Zn反应放出H2 B. 常温下,0.1 mol/L CH3COONa溶液的pH大于7 C. CH3COOH溶液与Na2CO3反应生成CO2 D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红 |
|
| 2. 选择题 | 详细信息 |
|
向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是 A. c(CO32?) B. c(Mg2+) C. c(H+) D. Ksp(MgCO3) |
|
| 3. 选择题 | 详细信息 |
|
下列有关NaHCO3溶液的说法正确的是 A. 该溶液中,H+、Al3+、Cl-能大量共存 B. 该溶液中c(H2CO3)<c(CO32-) C. 该溶液中阳离子总数大于阴离子总数 D. 常温下,加水稀释, 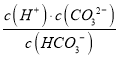 变小 变小 |
|
| 4. 选择题 | 详细信息 |
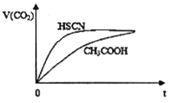
?定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是(? )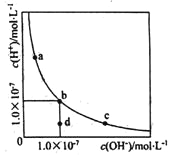 A. 升高温度,可能引起由c向b的变化 B. 该温度下,水的离子积常数为l.0×10-13 C. 该温度下,加入FeCl3可能引起由b向a的变化 D. 该温度下,稀释溶液可能引起由c向d的变化 |
|
| 5. 选择题 | 详细信息 |
|
下列物质的水溶液: ①NaOH? ②CH3COOH ③NH3 ④NaHCO3⑤Cl2 不能溶解CaCO3的是 A. ①③④ B. ①④⑤ C. ②④ D. ②⑤ |
|
| 6. 选择题 | 详细信息 |
|
常温下,下列说法不正确的是 A. pH=2与pH=1的CH3COOH 溶液中c(H+)之比为1:10 B. 等体积pH=2的H2SO4溶液和pH=2的CH3COOH溶液混合后溶液的pH=2 C. 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后溶液的pH<7 D. 0.1mol/L的CH3COOH 溶液中,由水电离的c(H)为1×10-13mol/L |
|
| 7. 选择题 | 详细信息 |
|
常温下,下列说法不正确的是 A. 0.2mol/L的NaHCO3溶液中: c(Na+)>c(HCO3-)>c(OH-)>c(H+) B. 叠氮酸(HN3)与醋酸酸性相近,0.1mol/LNaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) D. 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)= c(HC2O4-)+2c(H+) |
|
| 8. 选择题 | 详细信息 |
|
室温时,M(OH)2(s) A. |
|
| 9. 选择题 | 详细信息 |
改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数 ]。 ]。 下列叙述错误的是 A. pH=1.2时,c(H2A)=c(HA-) B. lg[K2(H2A)]=-4.2 C. pH =2.7时,c(HA-)>c(H2A)=c(A2-) D. pH=4.2时,c(HA-)=c(A2-)=c(H+) |
|
| 10. 选择题 | 详细信息 |
|
下列有关电解质溶液的说法正确的是( ) A. 在蒸馏水中滴加浓H2SO4,KW不变 B. CaCO3难溶于稀硫酸,也难溶于醋酸 C. 在Na2S 稀溶液中,c(H+)=c(OH?)-2c(H2S)-c(HS-) D. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
|
| 11. 选择题 | 详细信息 | |||||||||||||||
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生,为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是
|
||||||||||||||||
| 12. 选择题 | 详细信息 |
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( ) A. HA为强酸 B. 该混合液pH=7 C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A?)+ c(Y)=c(Na+) |
|
| 13. 选择题 | 详细信息 |
常温下,用0.01mol/LNaOH溶液滴定20.00mL0.01mol/LCH 3COOH溶液,所得滴定曲线如右图。下列说法正确的是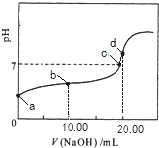 A. b点对应的溶液中: c(OH?)+c(CH3COO?) = c(Na+)+c(H+) B. a点对应溶液的pH= 2 C. C点表示NaOH溶液与CH3COOH溶液恰好完全反应 D. d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
|
||||||||||||||||
| 15. 选择题 | 详细信息 |
|
类似于水的离子积,难溶盐AmBn也有离子积Ksp,已知常温下BaSO4的溶解度为2.33×10-4g,则其Ksp为 A. 2.33×10-4 B. 1×10-5 C. 1×10-10 D. 1×10-12 |
|
| 16. 选择题 | 详细信息 |
|
准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol/LNaOH溶液滴定,下列说法正确的是 A. 滴定管用蒸馏水洗涤后,装入NaOH 溶液进行滴定 B. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 C. 随着NaOH溶液滴入,锥形瓶中溶液pH 由小变大 D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
|
| 17. 选择题 | 详细信息 |
|
25℃时,下列溶液中,离子浓度关系正确的是 A.pH=a的氨水稀释10倍后,其pH=b,则a=b+1 B.浓度相同的①NH4Cl ②CH3COONH4 ③NH4HSO4,三种溶液中的c(NH4+):①>③>② C.将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c (NH4+)> c (Cl-) > c (H+) > c (OH-) D.将a mol?L-1CH3COOH与b mol?L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
|
| 18. 选择题 | 详细信息 |
|
一定温度下,向300mL 1mol/L 的NaOH 溶液中通入bmolCO2,下列说法正确的是 A. 通入CO2过程中溶液的Kw减小 B. b=0.3 与b=0.15时,所得溶液中的微粒种类不相同 C. 当b=0.2 时,所得溶液中部分离子浓度关系为: c(HCO3-)>(CO32-)>c(OH-)>c(H+) D. 当恰好生成NaHCO3 时,溶液中存在: c(Na+)+c(H+)==c(HCO3-)+c(OH-) |
|
| 19. 综合题 | 详细信息 | ||||||||||
已知25℃时有关弱酸的电离平衡常数:
|
|||||||||||
| 20. 填空题 | 详细信息 |
|
某兴趣小组为探究沉淀溶解平衡的原理并测定某温度下PbI2溶度积常数,设计如下实验。 I.取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌,静置,过滤到洁净的烧杯中,得到滤液。 (1)搅拌的目的是___________________。 (2)取少量滤液于试管中,向其中滴加几滴0.1mol/LKI溶液,观察到的现象是________,溶液中c(Pb2+)_________ (填“增大”、“减小”或“不变”)。 Ⅱ.准确量取10.00mL滤液,与离子交换树脂(RH) 发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出溶液用中和滴定法测得n(H+)=3.000×10-5mol。 (3)在此实验温度下,PbI2的溶度积常数Ksp=_________。 (4)若步骤I盛装滤液的烧杯中有少量水,Ksp测定结果将会________(填“偏大”、“偏小”或“无影响”)。 |
|
| 21. 综合题 | 详细信息 |
|
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。 (1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是________。 (2)已知Ksp(AgCl)=1.8×10-10,向VmL0.018mol/L 的AgNO3溶液加VmL0.020mol/L 的盐酸,混合后溶液中的Ag+的浓度为______mol/L,pH 为________。 (3)AgNO3溶液光照易分解,生成Ag 和红棕色气体等物质,其光照分解的化学方程式为________。 (4)如图所示原电池正极的反应式为_________。  |
|
| 22. 填空题 | 详细信息 | ||||||||||
|
电解质的水溶液中存在电离平衡。 (1)醋酸是常见的弱酸。 ①醋酸在水溶液中的电离方程式为______________。 ②下列方法中,可以使醋酸稀溶液中CH3COOH 电离程度增大的是______(填字母序号)。 a.滴加少量浓盐酸 b.微热溶液 c.加水稀释 d.加入少量醋酸钠晶体 (2)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。 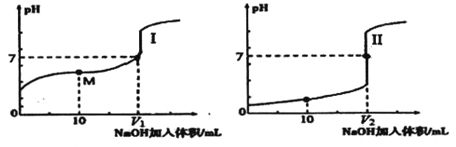 ①滴定醋酸的曲线是_________(填“I”或“Ⅱ”)。 ②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______。 ③V1和V2的关系: V1___V2 (填“>”、“=”或“<”)。 ④M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______。 (3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料: AgSCN是白色沉淀,相同温度下,溶解度: AgSCN>AgI。
|
|||||||||||