长沙市高一化学月考测验(2018年后半期)带答案与解析
| 1. | 详细信息 |
|
科学家预测,月球的土壤中吸附着数百万吨 A. B. C. 每个氦分子中含有的质子数为2、中子数为1 D. 该原子核中质子数为2、中子数为3 |
|
| 2. | 详细信息 |
下列有关化学用语表示正确的是 |
|
| 3. | 详细信息 |
|
下列关于元素周期表和元素周期律的说法正确的是 A. 整个元素周期表中,非金属元素约占五分之一 B. 第二周期元素从Li到F,原子半径逐渐增大 C. 因为Al比Na失去电子数多,所以Al比Na的还原性强 D. 整个元素周期表由7个主族、7个副族、1个0族和3个Ⅷ族组成 |
|
| 4. | 详细信息 |
|
下列关于元素周期表的说法正确的是 A. 能生成碱的金属元素都在ⅠA族 B. 稀有气体元素原子的最外层电子数均为8 C. 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 D. 原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
|
| 5. | 详细信息 |
|
下列叙述正确的是( ) A. F比S的非金属性强,故F的最高价氧化物对应的水化物的酸性大于硫酸 B. 因为H2O比H2S稳定,所以H2O比H2S的沸点要高一些 C. 如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于第ⅢA族或ⅢB族 D. 含有共价键的化合物可能是离子化合物,含有离子键的化合物可能是共价化合物 |
|
| 6. | 详细信息 |
|
下列说法不正确的是() A. F是最活泼的非金属元素 B. 根据F2与Cl2分别于H2反应的难易程度,不能判断氟元素与氯元素的非金属强弱 C. Na是短周期主族元素中原子半径最大的元素 D. 最外层电子数是2的元素,既可能是主族元素,也可能是0族元素,还可能是副族元素 |
|
| 7. | 详细信息 |
根据表中八种短周期元素的有关信息判断,下列说法错误的是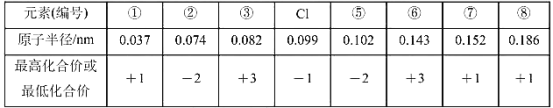 A. 元素②、⑥形成的化合物具有两性 B. 元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 C. 元素⑤对应的离子半径大于元素⑧对应的离子半径 D. C1的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
|
| 8. | 详细信息 |
|
元素周期表和周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( ) A. 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y B. 从元素周期表中金属与非金属分界线附近能找到半导体材料 C. Cs和Ba分别位于第六周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 D. 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
|
| 9. | 详细信息 |
|
A、B、C均为短周期元素,A、B同周期,其原子核外有三个电子层,A、C的最低价阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是 A. A元素的最高正价不可能是+6价 B. 原子半径:B>A>C C. 离子半径:B2+>C->A2- D. 氧化性:C<A |
|
| 10. | 详细信息 |
|
某短周期主族元素R的最高正化合价与最低负化合价的代数和为4,不列判断正确的是 A. R的氧化物对应的水化物的浓溶液具有脱水性 B. R的单质可与过量的O2在点燃条件下充分化合生成RO3 C. R的气态氢化物的沸点在同主族元素的氢化物中最低 D. R的气态氢化物易溶于水呈碱性 |
|
| 11. | 详细信息 |
短周期元素X、Y、Z、Q、W、R的原子序数与其常见化合价关系如下图所示。下列说法正确的是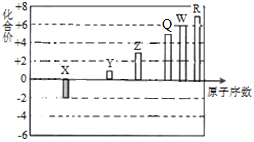 A. X、Y、R形成的某种化合物可以用于漂白、消毒 B. Q、W的最高价氧化物对应的水化物酸性前者大于后者 C. X、Y、Z、W、R的简单离子半径大小顺序为R>W>Z>Y>X D. Y、Z和W三者最高价氧化物对应的水化物间不能两两相互反应 |
|
| 12. | 详细信息 |
|
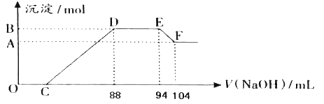
A、B、C、D是原子序数依次增大的四种短周期元素,其中元素D的焰色反应呈黄色,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而己是由C元素形成的单质,已知:甲+乙→丁+己,甲+丙→戊+己;丁由两种10电子粒子形成,则下列说法正确的是 A. 元素C形成的单质可以在点燃条件分别与元素ABD形成的单质化合,所得化合物均存在共价键 B. 元素BCD的原子半径由大到小的顺序为:r(D)>r(C)>r(B) C. 往 D. 1mol甲与足量的乙完全反应共转移约 |
|
| 13. | 详细信息 |
|
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是 A. X可能是第二周期非金属元素 B. Y可能与X同主族 C. X可能是第三周期金属元素 D. Y一定是金属元素 |
|
| 14. | 详细信息 |
|
下列叙述正确的是 A. B. CO2和BCl3分子中各原子最外层都满足8电子结构 C. D. 原子最外层电子数少于4的元素均为金属元素 |
|
| 15. | 详细信息 |
|
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数) ①若 ②若 ③若Y的最低化合价为-2,则Z的最高正化合价可能为+7 ④若X的最高正化合价为+5,则五种元素都是非金属元素 ⑤若Z的氧化物对应的水化物为HZO3,则Z的最外层电子数可能不为5 A. ②③⑤ B. ①②③ C. ②③ D. ②③④ |
|
| 16. | 详细信息 |
由短周期元素或生活中常见的金属元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 A. 若X是Na2CO3,C为一种温室气体,则A一定是氯气,且D和E不反应 B. 若A是单质,B和D的反应是 C. 若D为CO,C能和E反应,则A一定为 D. 若C的溶液遇KSCN显红色,则A可能为氮的一种氧化物 |
|
| 17. | 详细信息 |
|
Ⅰ.用化学用语回答下列问题: (1)写出 (2)用电子式表示二氧化碳分子的形成过程___________________. Ⅱ.下列物质: (3)含有极性键和非极性键的是_____________(填序号,下同); (4)含有极性键的离子化合物是________________; Ⅲ.下列物质: (5)互为同位素的是___________(填序号,下同); (6)互为同素异形体的是__________________. (7)氢的三种原子 |
|
| 18. | 详细信息 |
|
原子序数由小到大排列的四种短周期元素X、Y、Z、W的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。请回答下列问题: (1)Z、W形成的简单氢化物的稳定性由大到小的顺序为_________________(填化学式); (2)由X、Y、Z三种元素组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为____________________; (3)由X、Y、Z、W四种元素组成的一种离子化合物A,已知: ① ②A能与盐酸反应生成气体B,该气体能与氯水反应。 则A的化学式为__________,该气体B与氯水反应的离子方程式为__________________. |
|
| 19. | 详细信息 | ||||||||||||||
有甲、乙、丙、丁、戊、己六种短周期元素,其元素特征信息如下表所示:
|
|||||||||||||||
| 20. | 详细信息 |
某小组探究元素周期律,甲根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的研究;乙根据置换反应的规律,利用下图装置完成O元素的非金属性比S强的研究。回答: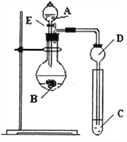 (1)图中A装置名称是______________。 (2)从以下所给物质中选出甲同学设计的实验所用到物质: ①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2 试剂A与C分别为_________(填序号);试管中发生反应的离子方程式为_______________.有同学认为此实验不能说明N、C、S的非金属性强弱,你认为原因是_________________ (3)乙同学设计的实验所用到试剂A为________;如果C试剂为硫化氢的水溶液,则试管中可以观察到的现象为_______________ |
|
| 21. | 详细信息 | |||
|
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,其化学式都可表示为Z2X2Y (1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为_________(填字母代号) A.离子键 B.极性共价键 C.非极性共价键 D.氢键 (2)下表为B与F实验的部分内容:
|
||||