2015-2016年高一下半期化学开学考试题带答案和解析(广西桂林十八中)
| 1. | 详细信息 |
|
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是( ) A.硅胶可用作食品干燥剂 B.烧碱固体可用作食品干燥剂 C.P2O5不可用作食品干燥剂 D.具有吸水性的植物纤维可用作食品干燥剂 |
|
| 2. | 详细信息 |
|
化学与生活密切相关,下列有关说法中不正确的是( ) A.氢氧化铁溶胶、含塑化剂的白酒、含有细菌的矿泉水均具有丁达尔效应 B.天宫一号中使用的碳纤维,是一种新型无机非金属材料 C.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 D.化石燃料的大量使用是产生PM2.5的主要原因之一 |
|
| 3. | 详细信息 |
|
下列电子式中,书写正确的是( ) A. B. C. D. |
|
| 4. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列有关说法正确的是( ) A.常温常压下,17g氨气所含的质子数为10NA B.1mol/L的Mg(NO3)2溶液中含有NO3-的数目为2 NA C.标准状况下,11.2LH2O所含分子数为0.5NA D.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3 NA |
|
| 5. | 详细信息 |
|
将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是( ) A.Mg、AlCl3、NaAlO2 B.KNO3、NaCl、CH3COONa C.NaClO、Na2SO3、BaCl2 D.Ba(NO3)2、FeSO4、NH4HCO3 |
|
| 6. | 详细信息 |
|
N、O、Si、S是重要的非金属元素,下列说法正确的是( ) A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱 B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质 C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应 D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2 |
|
| 7. | 详细信息 | |||||||||||||||||||||||||
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )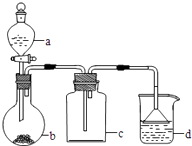
|
||||||||||||||||||||||||||
| 8. | 详细信息 |
|
下列叙述中正确的是( ). A.浓硫酸和浓盐酸长期暴露在空气中浓度降低,其原理相同 B.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 C.H与D,16O与18O互为同位素;D216O、H218O、D218O互为同素异形体; D.Be2+离子中的质子和电子微粒的个数比为2:1 |
|
| 9. | 详细信息 |
|
某化学活动小组需制备一定量的氢气,下列方法能达到目的的是( ) A.Cu和稀硝酸 B.Zn和浓硝酸 C.Fe和浓硫酸 D.Al和浓NaOH溶液 |
|
| 10. | 详细信息 |
|
核内中子数为N的R2+的离子,质量数为A,则n克它的氧化物中所含质子的物质的量为( ) A. B. C.(A-N+2) D. |
|
| 11. | 详细信息 |
用下列实验装置进行相应实验,能达到实验目的的是( ) A.用图1所示装置除去Cl2中含有的少量HCl B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C.用图3所示装置制取少量纯净的CO2气体 D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
|
| 12. | 详细信息 |
|
下列离子方程式中不正确的是( ) A.氢氧化钡溶液与硫酸混合:Ba2++2OH?+2H++SO42BaSO4↓+2H2O B.铁粉与硝酸银溶液反应:Fe + 2Ag+ = Fe2+ + 2Ag C.氯化铝溶液与过量的氨水反应:Al 3++4NH3?H2O?AlO2?+4NH4++2H2O D.氯气通入冷的氢氧化钠溶液中:Cl2+2OHCl?+ClO?+H2O |
|
| 13. | 详细信息 |
|
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的氢气体积(相同条件下)相等时,消耗的HCl和NaOH物质的量之比为( ) A.1:1 B.2:1 C.3:1 D.1:3 |
|
| 14. | 详细信息 |
|
下列反应中,能证明SiO2是酸性氧化物的是( ) ①SiO2+4HF=SiF4↑+2H2O ②SiO2+CaO ③SiO2+2NaOH=Na2SiO3+H2O ④SiO2+2C A.①② B.②③ C.③④ D.①④ |
|
| 15. | 详细信息 |
|
X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。已知X的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的最外层电子数是W原子最外层电子数的2倍,Z原子最外层只有一个电子。下列说法正确的是( ) A.最高价氧化物对应水化物的碱性:Z<W B.离子半径:Z >Y C.气态氢化物的稳定性:X>Y D.Z和W 两者最高价氧化物对应的水化物能相互反应 |
|
| 16. | 详细信息 |
|
下列有关实验原理、方法和结论都正确的是( ) A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ C.向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ D.已知I3? |
|
| 17. | 详细信息 |
X、Y、Z、W四种物质的转化关系.下列组合中不符合该关系的是( )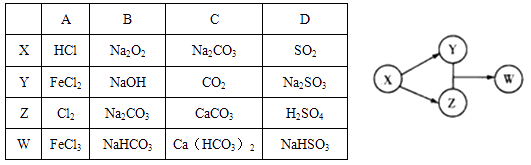 A.A B.B C.C D.D |
|
| 18. | 详细信息 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( ) A.洗气瓶中产生的沉淀是BaCO3 B.在Z导管出来的气体中无CO2 C.洗气瓶中产生的沉淀是BaSO3 D.在Z导管口有红棕色气体出现 |
|
| 19. | 详细信息 | ||||||||||||||||||
|
(1)下列两组溶液分别选用一种试剂鉴别,写出试剂的化学名称. ①NaCl、Na2CO3、Na2SiO3、Na2SO3试剂: ②Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4试剂: (2)除去表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法和反应的化学方程式.
|
|||||||||||||||||||
| 20. | 详细信息 | ||||||||||||||||||||||||||||||||||||
下表列出了①~⑨九种元素在周期表中的位置。
请按要求回答下列问题: |
|||||||||||||||||||||||||||||||||||||
| 21. | 详细信息 |
|
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: ①高温下用碳还原二氧化硅制得粗硅。 ②粗硅与干燥 HCl气体反应制得 SiHCl3:Si + 3HCl ③SiHCl3与过量H2在 1000 ~1100℃反应制得纯硅 已知 ①SiHCl3能与 H2O强烈反应,在空气中易自燃②普通玻璃在6000C左右融化。 请回答下列问题: (1)第①步制备粗硅的化学反应方程式为 。 (2)粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点57.6℃) 和 HCl(沸点-84.7℃),提纯 SiHCl3 采用的方法为 。 (3)用 SiHCl3 与过量 H2 反应制备纯硅的装置如下(热源及夹持装置略去):  ①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是 。 ②反应一段时间后,装置 D中观察到的现象是 , 装置 D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。 ③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。 ④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。 A 碘水 B 氯水 C NaOH溶液 D KSCN溶液 E Na2SO3 溶液 |
|
| 22. | 详细信息 |
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图1所示(图中有些反应的生成物和反应的条件没有标出). 请回答下列问题: (1)写出下列物质的化学式:B 、丙 、乙 . (2)写出下列反应的离子方程式: 反应① ; 反应⑤ ; 反应⑥ . (3)将0.4g D和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol?L?1稀盐酸.在如图2所示的坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象 . (4)将18.4 g D 和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算混合物中NaOH的质量分数。(请写出计算过程) |
|
最近更新



