2017-2018年高一上学期第二次月考化学考卷带参考答案和解析(贵州省遵义市第四中学)
| 1. | 详细信息 |
学习化学过程中需要经常做实验。下列实验操作正确的是( )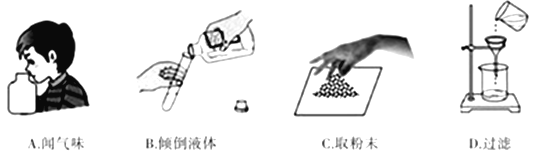 A. A B. B C. C D. D |
|
| 2. | 详细信息 |
|
下列叙述中正确的是 A. 含最高价元素的化合物,一定具有强氧化性 B. 阳离子只有氧化性,阴离子只有还原性 C. 失电子越多,还原性越强 D. 强氧化剂与强还原剂不一定能发生氧化还原反应 |
|
| 3. | 详细信息 |
|
下列有关铁及其化合物的说法中不正确的是 ( ) A. 氯化亚铁可以被氧化生成 FeCl3,所以氯化亚铁只具有还原性 B. 将饱和FeCl3溶液滴入沸水中,能形成胶体 C. 新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色 D. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤 |
|
| 4. | 详细信息 |
|
氯化铁溶液与氢氧化铁胶体具有的共同性质是 A.都不稳定 B.能透过滤纸 C.分散质粒子直径在1 nm~100 nm之间 D.呈红褐色 |
|
| 5. | 详细信息 |
|
下列说法错误的是( ) A. 钠的化学性质很活泼,所以需要将其放在煤油中保存 B. 铝制品在生活中非常普遍,这是因为铝不活泼 C. 镁因在空气中形成了一薄层致密的氧化膜,保护了里面的镁,故镁不需要像钠似的进行特殊保护 D. 铁在潮湿的空气中因生成的氧化物很疏松,不能保护内层金属,故铁制品往往需涂保护层 |
|
| 6. | 详细信息 |
|
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行: ①TiO2+2C+2Cl2 ②TiCl4+2Mg 对于上述两个反应的叙述正确的是( ) A. 都是置换反应 B. TiO2做氧化剂 C. ②中反应中钛元素被还原 D. Cl2被氧化 |
|
| 7. | 详细信息 |
|
由铁、锌、铝、镁四种金属中的两种组成的混合物11 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是( ) A. 铁 B. 锌 C. 镁 D. 铝 |
|
| 8. | 详细信息 |
|
下列各组反应中最终肯定是白色沉淀的是( ) A. 单质钠投入 MgCl2溶液 B. AlCl3溶液中加入过量KOH溶液 C. FeCl2溶液中加入过量氨水 D. Fe2(SO4)3溶液中加入过量KOH溶液 |
|
| 9. | 详细信息 |
|
下列物质中,既能导电又属于电解质的一组物质是( ) A. 石墨、食醋 B. 泥水、石灰水 C. 熔融NaCl、熔融Ca(NO3)2 D. 稀硫酸、蔗糖 |
|
| 10. | 详细信息 |
|
下列反应中,反应后固体物质质量减小的是 ( ) A. 二氧化碳通过Na2O2粉末 B. 镁条在二氧化碳中燃烧 C. CO通过灼热的CuO粉末 D. 将铝粉投入CuSO4溶液 |
|
| 11. | 详细信息 |
|
下列反应中必须加入还原剂才能进行的是 ( ) A. FeCl3→FeCl2 B. Zn→ Zn2+ C. H2O2→H2O D. CuO→CuCl2 |
|
| 12. | 详细信息 |
|
下列操作中,不会发生明显颜色变化的是 (? ) A. 硫酸铜固体溶于水中 B. 氧化钙变成石灰石 C. 氯化铁溶液中加入铜粉 D. 硫酸亚铁溶液中通入氯气 |
|
| 13. | 详细信息 |
|
下列各组物质中,分子数不相同的是 ( ) A. 同温同压下5 LH2和5 L CO2 B. 0.2molHCl和6.4g氧气 C. 标准状况下1mol氮气和22.4 L水 D. 71g氯气和标准状况下22.4LHe |
|
| 14. | 详细信息 |
|
下列叙述正确的是 ( ) A. 3 mol H2O的摩尔质量为18g/mol B. CH4的摩尔质量为16g C. 3.01×1023个SO2分子的质量为64g D. 标准状况下,1 mol任何物质体积均为22.4L |
|
| 15. | 详细信息 |
|
今有Na2O和 Na2O2的混合物共70g,溶于水后刚好被400 mL 5 mol?L-1的盐酸中和,则混合物中Na2O和 Na2O2的物质的量之比为 ( ) A. 4:5 B. 1?1 C. 3?4 D. 任意比 |
|
| 16. | 详细信息 | |||||||||||||||
下列除杂试剂或操作方法正确的一组是( )
|
||||||||||||||||
| 17. | 详细信息 |
|
下列物质反应后一定有+3价铁生成的是( ) ①少量 Fe在Cl2燃烧;② Fe与过量稀H2SO4反应;③ FeCl2溶液中加入氢氧化钠溶液;④ FeO和Fe2O3的混合物溶于盐酸中。 A. ① ② ④ B. ① ③ ④ C. ① ② ③ D. ② ③ ④ |
|
| 18. | 详细信息 |
|
下列反应的离子方程式不正确的是( ) A. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO3- B. Na跟稀硫酸反应:2Na+2H+=2Na++H2↑ C. Na2O投入水中:Na2O+H2O=2Na++2OH- D. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ |
|
| 19. | 详细信息 |
|
下列各组物质不能实现直接转化的是( ) A. Mg→MgO→MgCl2→Mg(OH)2 B. Cu→CuCl2→Cu(NO3)2→Cu(OH)2 C. Fe→Fe3O4→Fe(OH)3→Fe2O3 D. Na→Na2O2→Na2CO3→NaCl |
|
| 20. | 详细信息 |
|
下列实验操作中错误的是 ( ) A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 B. 蒸馏操作时,应使温度计水银球与蒸馏烧瓶的支管口处在同一直线上 C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D. 萃取碘水中的碘时,可选择苯或四氯化碳作萃取剂 |
|
| 21. | 详细信息 |
|
常温下,下列各组离子一定能在指定溶液中大量共存的是( ) A. 碱性的溶液中:NH4+、Cu2+、NO3-、SO42- B. 能使石蕊变红的溶液:Ca2+、K+、HCO3-、CO32- C. 与Al反应放出氢气溶液中:Ba2+、Fe3+ 、Cl-、NO3- D. 无色透明的溶液中:Na+、Al3+、Cl-、NO3- |
|
| 22. | 详细信息 |
|
下列关于钠的化合物的说法中,错误的是(? ) A. Na2CO3和NaHCO3均能与盐酸溶液反应 B. Na2CO3固体中含有的NaHCO3可用加热的方法除去 C. Na2O2和Na2O均为固体,与CO2反应均放出O2 D. 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象不相同 |
|
| 23. | 详细信息 |
|
不添加任何试剂无法区分的一组溶液是( ) A. MgCl2和KOH B. Na2CO3和CuSO4 C. KOH和AlCl3 D. Na2CO3和盐酸 |
|
| 24. | 详细信息 |
|
把33.6L CO2通过一定量的固体过氧化钠后收集到22.4 L气体(气体的测量均在标准状况下),下列说法中正确的是( ) A. 22.4 L气体的总质量是30g B. 反应中共转移1.5mol电子 C. 有70g过氧化钠参加反应 D. 混合气体的体积比为1:1 |
|
| 25. | 详细信息 |
|
根据以下几个反应: ①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3 ③2FeCl3+2KI=2FeCl2+2KCl+I2 ④I2+SO2+2H2O=H2SO4+2HI 判断氧化性由强到弱的顺序是(? ) A. Cl2>I2>Fe3+>SO42- B. Cl2>Fe3+>I2>SO2 C. Cl2>I2>SO2>Fe3+ D. Fe3+>I2>Cl2>SO42- |
|
| 26. | 详细信息 |
|
A、B、C、D、E是高中阶段学习的常见单质或化合物,金属单质A在常温下可以和氧气生成化合物C,且A可以和氢氧化钠溶液反应。化合物E淡黄色物质,可用于呼吸面具,可由一种活泼金属D在氧气中燃烧得到。单质B是所含元素在地壳中含量居于第四。回答问题: (1)物质E的化学式___________,E与水反应的离子方程式____________________。 (2)单质A与NaOH反应的离子方程式_______________________,化合物C与硫酸反应的离子方程式:_______________________________。 (3)单质B与水蒸汽反应的化学方程式为___________________________________。 (4)单质D与CuSO4溶液反应的化学方程式为__________________________。 (5)活泼金属D与水的反应中,做___________(填“氧化剂”或“还原剂”)。 |
|
| 27. | 详细信息 |
|
(1)下列五个反应 A.5Cl2+I2+6H2O=10HCl+2HIO3 B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O D.2NaCl+2H2O E.MnO2+4HCl 上述反应中氯元素只被氧化的是_____________,(填字母,下同)只被还原的是_____________,部分被氧化的是_____________,C中被氧化与被还原的物质的量之比为_____________。 (2)在反应4(NH4)2SO4 (3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反应中,若产生2mol N2,转移电子数为_________(用NA表示阿伏加德罗常数);用“双线桥”表示反应中电子转移,化合价的变化,反应类型:______________。 (4)将等质量的两份镁、铝合金分别投入足量的NaOH和HCl中,在相同的情况下测得生成气体的体积之比为1:2,求合金中镁、铝的物质的量之比为___________。 |
|
| 28. | 详细信息 |
实验装置用于验证NaHCO3的稳定性,做了如下下实验。D为固定蚊香的硬纸片。试回答下列问题: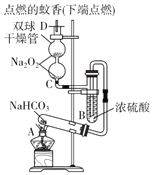 (1)在A试管内发生反应的化学方程式是_________________________。 (2)在双球干燥管内发生反应的化学方程式为_______________________________。 (3)双球干燥管内观察到的实验现象是_________________________。通过上面的实验现象某同学受到启发用如图所示装置制取纯净的氧气.试回答下列问题: 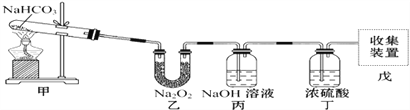 (4)丙中NaOH溶液的作用是______________,丁中浓硫酸的作用是____________。 (5)若把原装置连接顺序改为甲→丙→乙→丁→戊,则在装置戊中能否收集到氧气?____(填“能”或“不能”),原因是___________________________________________。 |
|
| 29. | 详细信息 |
|
某无色混合物水溶液,可能含有以下离子中的若干种:?K+、?Fe3+、?Ba2+、④CO32-、⑤SO42-、⑥NO3-。取100mL该溶液进行如下实验: I.向该溶液中加入过量的稀盐酸,无气体生成; II.向I中所得的滤液中滴加足量Na2SO4溶液产生白色沉淀; 试回答下列问题: (1)肯定存在的离子有___________,(填序号,下同)肯定不存在的离子有_____________ ;写出II中的离子方程式________________________。 (2)可能存在的离子是____________,判断其中阳离子存在与否的方法是_____________。 |
|
最近更新



