天津市2020-2021学年九年级上学期第二次月考化学试题含解析
| 1. | 详细信息 |
|
将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是 A .高锰酸钾 B .菜籽油 C .面粉 D .白糖 |
|
| 2. | 详细信息 |
|
香烟烟气中易与血红蛋白结合的是 ( ) A .水蒸气 B . CO C . CH 4 D . CO 2 |
|
| 3. | 详细信息 |
|
下列物质或方式中的 “ 碳 ” ,主要不是针对碳单质的是 A .碳素墨水 B .打印碳粉 C .低碳生活 D .石墨碳棒 |
|
| 4. | 详细信息 |
|
下列不能与稀盐酸反应的金属是 A . Cu B . Zn C . Al D . Mg |
|
| 5. | 详细信息 |
|
有甲、乙、丙、丁四种金属,只有丙在自然界能以单质形态存在。含甲化合物的水溶液不能用乙制的容器盛放。将甲和丁分别放入硝酸铜溶液中,在甲表面有铜析出,而丁没有变化。这四种金属活动性顺序由弱到强的是 A .丙 < 丁 < 甲 < 乙 B .乙 < 甲 < 丁 < 丙 C .丁 < 甲 < 乙 < 丙 D .丙 < 乙 < 甲 < 丁 |
|
| 6. | 详细信息 |
|
物质的性质决定了物质的用途,下列物质的性质与用途不对应的是( ) A .金刚石硬度大,可用于切割玻璃 B .一氧化碳有可燃性,可作为燃料 C .二氧化碳能与水反应,可用于灭火 D .活性炭有吸附性,在制糖工业中用活性炭脱色以制白糖 |
|
| 7. | 详细信息 |
|
中华传统文化蕴含丰富的化学知识。从化学视角对下列俗语,诗词的解释错误的是( ) A . “ 满架蔷薇一院香 ”—— 分子在不断地运动 B . “ 百炼成钢 ”—— 降低生铁中碳元素的含量 C . “ 只要功夫深,铁杵磨成针 ”—— 发生的是物理变化 D . “ 金入于猛火,色不夺精光 ” —— 金在加热的条件下能与氧气反应 |
|
| 8. | 详细信息 |
|
现有 Al 、 Cu 、 Ag 三种金属,限用一种试剂一次性就可以验证它们的金属活动性强弱,则该试剂是 A . CuSO 4 溶液 B .稀 H 2 SO 4 C . AgNO 3 溶液 D . AlC1 3 溶液 |
|
| 9. | 详细信息 |
|
下列物质的用途中,利用其化学性质的是 A .铜用于制作导线 B .干冰用作制冷剂 C .铜用于制作铜火锅 D .赤铁矿用于炼铁 |
|
| 10. | 详细信息 |
|
关于下列变化过程: CO 2 →CO , H 2 →H 2 O , CO→CO 2 , C→CO 2 ,正确的说法是 ① 只有通过化合反应实现 ② 反应前后 C 、 H 、 O 三种元素的化合价都发生了变化 ③ 都需要在一定条件下才能实现 ④ 都可以通过与单质反应实现 A . ①③ B . ②④ C . ②③ D . ③④ |
|
| 11. | 详细信息 |
|
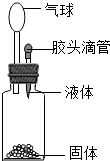
要使如图装置中的小气球鼓起来,则使用的固体和液体可以是 ① 固体氢氧化钠和水 ② 铁和稀硫酸 ③ 硝酸铵和水 ④ 生石灰和水 ⑤ 石灰石和稀盐酸 A . ②③④⑤ B . ③④⑤ C . ①②④⑤ D . ②③④ |
|
| 12. | 详细信息 |
|
下图是探究铁钉锈蚀条件的 4 个实验,一段时间后观察现象。下列说法不正确的是 A . ① 中甲、乙、丙三处比较,生锈最明显的地方是甲 B . ①② 对比说明铁生锈需要空气, ①③ 对比说明铁生锈需要水 C . ③ 中附着在棉花上的氯化钙的作用是作干燥剂 D .四个实验中,生锈最快的是 ④ 中的铁钉 |
|
| 13. | 详细信息 |
|
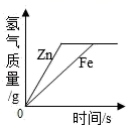
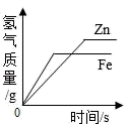
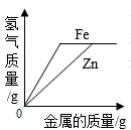
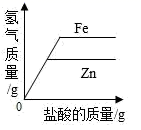
相同质量的镁、铝、锌分别与相同质量 20% 的盐酸充分反应,产生氢气质量 ( 直接用各金属表示 ) 大小关系有以下几种猜测: ①Mg > Al > Zn ; ②Al > Mg > Zn ; ③Al = Mg = Zn ; ④Al = Mg > Zn ; ⑤Al = Zn > Mg ; ⑥Al > Mg = Zn 。其中合理的个数为 A . 5 个 B . 4 个 C . 3 个 D . 2 个 |
|
| 14. | 详细信息 |
|
下列图象中有关量的变化趋势与对应关系不正确的是 ( ) A .等质量、等质量分数的稀盐酸分别与足量的等质量的铁和锌反应 B .等质量的铁和锌分别与等质量、等质量分数的足量的稀盐酸反应 C .向等质量、等质量分数的稀盐酸中不断加入等质量的铁和锌 D .向等质量的铁和锌中不断加入等质量、等质量分数的稀盐酸 |
|
| 15. | 详细信息 | |||||||||
|
一定量的碳与 8.0g 氧化铜混合加热,充分反应 ( 如图所示 ) ,反应前后测定装置 I 、装置 II 的质量记录如下。下列分析正确的是
①I 中减少的质量是氧元素的质量 ② 生成的气体一定是混合物 ③II 中增加的质量是吸收的二氧化碳的质量 ④ 反应后 I 中固体成分可能有 3 种情况 A . ①② B . ②③ C . ②④ D . ③④ |
||||||||||
| 16. | 详细信息 |
|
下列说法正确的是 ( ) A .二氧化碳能使紫色石蕊溶液变红,说明二氧化碳具有酸性 B .煤炉上放一盆水可防止 CO 中毒 C .用墨绘制的古画经久不变色,说明碳不与任何物质反应 D . CO 2 能溶于水, CO 难溶于水 |
|
| 17. | 详细信息 |
|
2.3g 铁和 M 的混合物与足量的盐酸反应,生成 0.2g 氢气,则 M 可能是 A .镁 B .铝 C .碳 D .钠 |
|
| 18. | 详细信息 | ||||||||||||||||||||
|
除去下列各物质中混有的少量杂质,所用试剂正确的是 ( )
A . A B . B C . C D . D |
|||||||||||||||||||||
| 19. | 详细信息 |
|
碳酸锌与碳酸钙其有相似的化学性质。现将 12.5g 碳酸锌固体高温锻烧一段时间,冷却后,向剩余固体中加入足量稀硫酸。下列结论正确的是 ( 已知: ZnO + H 2 SO 4 =ZnSO 4 + H 2 O) A .共生成 16.1g 硫酸锌 B .煅烧越充分则消耗的硫酸越少 C .煅烧后固体中氧元素的质量分数增大 D .最终生成二氧化碳的总质量与煅烧时间的长短无关 |
|
| 20. | 详细信息 |
|
工业上在一定条件下, CO 2 和 H 2 以分子个数之比为 1:3 恰好反应,得到了某重要的 化工原料和水。该化工原料的化学式不可能为 A . C 2 H 6 B . C 6 H 12 C . C 2 H 6 O D . C 3 H 8 O 2 |
|
| 21. | 详细信息 |
|
按要求填空 (1) 铁生锈是铁与 _____ 和 _______ 接触从而生锈 (2) 工业炼铁中 , 焦炭的作用是 ______ 和 _________ (3) 洗洁精可使餐具上的油污 _____ (4) 铝制品常温下不易锈蚀的原因是 _________ |
|
| 22. | 详细信息 |
|
在相同温度和相同体积的条件下,气体压强 (p) 与气体分子数目 (n) 成正比关系 (p=kn) 。若 ag 碳和 bg 氧气放入一密闭容器中,此时测得容器内的气体压强为 P 0 ,然后,提供一定条件使容器内的物质发生充分反应得生成物 (a+b)g ,待温度复原时,测得容器内的气体压强为 P 1 ,若 P 0 < P 1 则 a 和 b 的比值范围为 _____ 。 |
|
| 23. | 详细信息 |
|
写出下列反应的化学方程式 (1) 炼铁原理 ( 用赤铁矿 )_____ (2) 吸热的化合反应 _____ (3) 铝和硫酸铜溶液 _____ (4) 酒精燃烧 _____ |
|
| 24. | 详细信息 |
|
金属在生产、生活中应用广泛,金属的回收利用有利于保护环境、节约资源。 (1) 用体温计测量体温时,水银柱会上升。用微观知识解释产生该现象的原因 _____ 。 (2) 我国古代典籍中有 “ 银针验毒 ” 的记载。 “ 银针验毒 ” 的反应原理之一是: 4Ag+2H 2 S+O 2 =2X+2H 2 O , X 的化学式为 ______ 。 (3) 某工厂欲从溶质是 AgNO 3 和 Cu(NO 3 ) 2 的生产废液中回收 Ag 和 Cu 。实验员取样,向其中加入一定量的锌,充分反应后过滤,得到滤渣和滤液 ( 已知: AgNO 3 +HCl=AgCl↓+HNO 3 ) 。 ① 若向所得滤液中加入盐酸产生白色沉淀,则滤液中一定含有 ______ 。 ② 若所得滤液为无色,则滤渣中一定含有 _____( 填化学式,下同 ) ,可能含有 ______ 。 (4) 现有某铁样品 5.6g ,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为 9.8% 的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如下图所示。 则下列结论正确的是 _____( 填序号 ) ① 恰好完全反应时,一定没有固体剩余 ②x 的值为 0.2 ③ 铁样品中可能含有镁 ④M 点对应的溶液中含有 2 种或 3 种溶质 (5) 用含 Fe 2 O 3 60% 的赤铁矿石 800t ,理论上可炼出含铁 98% 的生铁 _____ 吨。 (6) 已知某铁的氧化物可表示为 Fe a O b =xFeO·yFe 2 O 3 。经测: 15.2 克的某铁的氧化物中铁元素的质量为 11.2 克。则 x∶y=_____( 填最小整数比 ) 。 |
|
| 25. | 详细信息 |
|
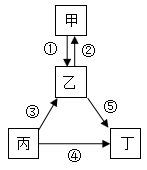
甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示。 (1) 若甲和丁均为单质,丙和乙是组成的元素相同且含有氧元素, 则丙的名称为 _____ ,属于分解反应的有 _____( 填序号 ) 。 (2) 若甲、乙、丙、丁均含有同一种元素,且甲中含有三种元素, 其中一种为金属元素,乙、丙、丁均为氧化物,且丙为黑色固体, 写出化学方程式 ②_____③_____ 。 |
|
| 26. | 详细信息 |
|
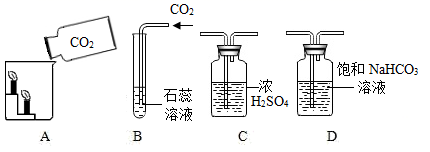
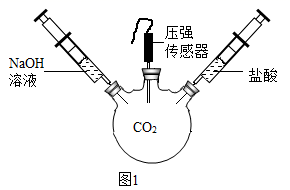
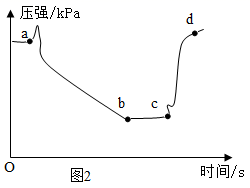
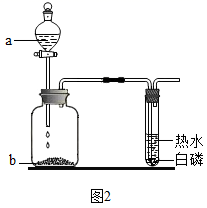
实验 Ⅰ:某化学小组探究用制得的二氧化碳气体进行性质实验。如图是有关实验的部分装置,请根据要求回答问题: ( 1 ) 甲同学利用装置 A 进行性质实验,观察的现象 ______ ,甲同学得出二氧化碳的性质 ______ 。 ( 2 ) 乙同学利用装置 B 进行性质实验时,观察到紫色石蕊试液变红色,将红色液体充分加热未能重新变为紫色,你认为可能的原因是 ______ ;为使上述红色液体加热后能重新变为紫色,在气体通入装置 B 之前可接入上图装置 ______ (填字母序号);在该装置中发生的主要化学反应方程式为 ______ 。 实验 Ⅱ:用图 1 装置进行实验,先后将溶液快速全部推入,测得一段时间内压强变化如图 2 所示。 ( 3 ) 先推入的溶液是 ______ 。 ( 4 ) cd 段压强变大,用化学方程式解释: ______ 。 |
|
| 27. | 详细信息 |
|
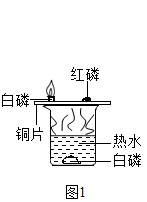
某化学兴趣小组同学利用以下三组装置探究燃烧的条件 (1) 如图 1 所示,实验中 _________ ( 填字母 ) 对比说明燃烧时 _____ ( 答一点 ) 。 A 水中的白磷 B 铜片上的白磷 C 铜片上的红磷 (2) 如图 2 所示,将液体 a 滴入集气瓶中并与固体 b 接触,整个实验中可观察到试管中 的现象是 _____ ,集气瓶内发生反应的化学方程式为 _____ 。 (3) 已知过氧化钠与二氧化碳反应会生成氧气和碳酸钠。如图 3 所示,在空气中放置 时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有: ① _____ ; ② 粘有过氧化钠的棉花燃烧; ③ 未粘有过氧化钠的棉花不燃烧.通过上述实 验的对比分析,写出产生现象 ② 的原因 _____ . |
|
| 28. | 详细信息 |
|
将 15 g 镁、铁、锌的混合物放入 200 g 稀硫酸中恰好完全反应,然后将所得混合溶液在无氧条件下进行蒸发,得到 63 g 不含结晶水的固体,则所用稀硫酸的溶质质量分数为 __________ 。 |
|
| 29. | 详细信息 |
|
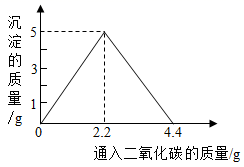
某实验小组在一定量的石灰水中通入 CO 2 ,产生沉淀的质量与通入 CO 2 质量的关系如下图 所示。已知反应: CaCO 3 +H 2 O+CO 2 =Ca(HCO 3 ) 2 ,其中 CaCO 3 、 Ca(HCO 3 ) 2 均属于盐且 Ca(HCO 3 ) 2 能溶于水。 (1) 请描述实验过程中可观察到的现象 。 (2) 若向含有 Ca(OH) 2 3.7g 的澄清石灰水里缓缓通入一定量的 二氧化碳,反应后若生成 4g 沉淀,则通入二氧化碳的质量为 g 或 g 。 |
|
| 30. | 详细信息 | ||||||||||||||||||
|
某兴趣小组的同学为测定某石灰石中碳酸钙 ( 假设:石灰石中的杂质不与盐酸反应 ) 的质量分数,称取一定质量的石灰石置于烧杯中,用某浓度的稀盐酸 100g ,分 5 次加入,每次充分反应后,取出固体,经过滤、洗涤、干燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下。请细心观查表格和图像,回答下列问题:
计算: (1) 表格中 m= g , n= g 。 (2) 该石灰石样品中碳酸钙的质量分数。 (3) 稀盐酸中 HCl 的质量分数。 |
|||||||||||||||||||