2016内蒙古高一下学期人教版高中化学单元测试
| 1. | 详细信息 |
|
5.6 g铁粉投入到足量的100 mL 2 mol/L的稀硫酸中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是 ( ) A.υ(Fe)=0.5 mol/(L·min) B.υ(H2SO4)=1 mol/(L·min) C.υ(H2SO4)=0.5 mol/(L·min) D.υ(FeSO4)=1 mol/(L·min)
|
|
| 2. | 详细信息 |
|
升高温度时,化学反应速率加快,主要原因是 ( ) A.分子运动速率加快,使该反应物分子的碰撞机会增多 B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 C.该化学反应的过程是吸热的 D.该化学反应的过程是放热的
|
|
| 3. | 详细信息 |
|
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
|
|
| 4. | 详细信息 |
|
在2L的密闭容器内充入5 mol A和2.5 mol B使之发生反应:3A(g)+B(g) A.恢复至原温度,容器内压强增大 B.A的平均反应速率为0.1 mol·L-1·min-1 C.达到平衡时,B比A的转化率小 D.B的平衡浓度为0.25 mol·L-1
|
|
| 5. | 详细信息 |
|
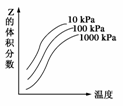
如图是温度和压强对X+Y A.上述可逆反应的正反应为放热反应 B.X、Y、Z均为气体 C.X和Y中只有一种为气态,Z为气态 D.上述反应的逆反应ΔH>0
|
|
| 6. | 详细信息 |
|
B.A、C两点气体的颜色:A深,C浅 C.由状态B到状态A,可以用加热的方法 D.A、C两点气体的平均相对分子质量:A>C
|
|
| 7. | 详细信息 |
|
一定温度下,反应2SO2+O2 A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
|
|
| 8. | 详细信息 |
|
下列表述中正确的是 ( ) A.任何能使熵值增大的过程都能自发进行 B.已知热化学方程式2SO2(g)+O2(g) C.化学平衡发生移动,平衡常数一定发生变化 D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
|
|
| 9. | 详细信息 |
|
在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生反应: 2SO2(g)+O2(g) A.保持温度和容器体积不变,充入1 mol SO3(g) B.保持温度和容器内压强不变,充入1 mol SO3(g) C.保持温度和容器内压强不变,充入1 mol O2(g) D.保持温度和容器内压强不变,充入1 mol Ar(g)
|
|
| 10. | 详细信息 |
|
利用反应2NO(g)+2CO(g) C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
|
|
| 11. | 详细信息 |
|
反应:xA(g)+yB(g) C.B的转化率升高 D.C的体积分数降低
|
|
| 12. | 详细信息 |
|
对于化学反应能否自发进行,下列说法中错误的是 ( ) A.若ΔH<0,△S>0,任何温度下都能自发进行 B.若ΔH>0,△S<0,任何温度下都不能自发进行 C.若ΔH>0,△S>0,低温时可自发进行 D.若ΔH<0,△S<0,低温时可自发进行
|
|
| 13. | 详细信息 |
|
向恒温、恒容(2 L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应: 2SO2(g)+O2(g) 4 min后达到平衡,这时c(SO2)=0.2 mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是 ( ) A.2 min时,c(SO2)=0.6 mol·L-1 B.用O2表示4 min内的反应速率为0.1 mol·(L·min)-1 C.再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 D.4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小
|
|
| 14. | 详细信息 |
|
现有下列两个图像: 下列反应中符合上述图像的是 ( )
A.N2(g)+3H2(g) B.2SO3(g) C.4NH3(g)+5O2(g) D.H2(g)+CO(g)
|
|
| 15. | 详细信息 |
|
在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应: 2X(g)+Y(g) 当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则 (1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。 (2)化学计量数a的值为____________。 (3)有同学认为,Q1一定小于Q,你认为该结论是否正确?____________其理由是__________________________________。 (4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。 A.2 mol X、1 mol Y、1 mol Ar B.a mol Z、1 mol W C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1 mol Y、1 mol Z (5)X的转化率α=____________(用含Q、Q1的代数式表示)。
|
|
| 16. | 详细信息 |
|
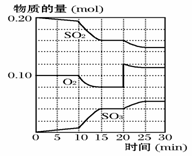
2SO2(g)+O2(g) (1)写出该反应的化学平衡常数表达式:K= 。降低温度,该反应K值__________(填“增大”、“减小”或“不变”)。 (2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如下图所示,反应处于平衡状态的时间是 ________________ 。 (3)据图判断,反应进行至20min时,曲线发生变化的原因是__________________________________________________(用文字表达), 10min~15min的曲线变化的原因可能是______________(填写编号)。 a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
|
|
| 17. | 详细信息 |
|
向体积为2 L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应: 2X(g) (1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为_____________ mol·L-1·min-1; (2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol·L-1·min-1; 乙:v(Y)=2 mol·L-1·min-1;丙:v(Z)=4.5 mol·L-1·min-1;丁:v(X)=0.075 mol·L-1·min-1。若其它条件相同,温度不同,则温度由高到低的顺序 是______________________(填序号) ; (3)若向达到(1)的平衡体系中充入氮气,则平衡向_______(填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向________(填“左”或“右”或“不”)移动; (4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较___________: A.无法确定 B.前者一定大于后者 C.前者一定等于后者 D.前者一定小于后者
|
|
| 18. | 详细信息 |
|
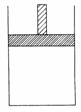
150 ℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4 L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4 L,容器内气体对相同条件的氢气的相对密度为5。 (1)反应前混合气体中V(N2):V(H2)=____________;反应达平衡后V(NH3)=____________L;该反应中N2转化率为____________。
①充入NH3时,混合气体的密度将____________,在达到平衡的过程中,混合气体的密度将____________(填“增大”、“减小”或“不变”)。反应重新达平衡的混合气体对氢气的相对密度将____________5(填“>”、“<”或“=”)。 ②下列哪些实验现象或数据能说明反应重新到达了平衡____________。 A.容器不再与外界发生热交换 B.混合气体的平均相对分子质量保持不变 C.当V(N2):V(H2):V(NH3)=1:3:2时 D.当容器的体积不再发生变化时 ③写出该反应的热化学方程式:__________________________________。
|
|
 反应
反应