2017иҫҪе®Ғй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
RгҖҒQдёәзҹӯе‘Ёжңҹдёӯзҡ„дёӨз§Қе…ғзҙ пјҢRе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°дёҺж¬ЎеӨ–еұӮз”өеӯҗж•°д№Ӣе·®зҡ„з»қеҜ№еҖјзӯүдәҺз”өеӯҗеұӮж•°пјӣQе…ғзҙ зҡ„еҺҹеӯҗжҜ”Rе…ғзҙ зҡ„еҺҹеӯҗеӨҡ2дёӘж ёеӨ–з”өеӯҗпјҢеҲҷдёӢеҲ—еҸҷиҝ°дёӯиӮҜе®ҡдёҚжӯЈзЎ®зҡ„жҳҜ пјҲВ В В пјүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В A.еҺҹеӯҗеҚҠеҫ„пјҡR>QВ В В В В В В В В В В В В В В В В В В В В В В В B.Rе’ҢQеҸҜеҪўжҲҗзҰ»еӯҗеҢ–еҗҲзү© C.Rе’ҢQеҸҜеҪўжҲҗе…ұд»·еҢ–еҗҲзү©RQ2В В В В В В В В В В В В В D.Rе’ҢQеҸҜеҪўжҲҗе…ұд»·еҢ–еҗҲзү©RQ3
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёӢеҲ—е®һйӘҢж“ҚдҪңгҖҒзҺ°иұЎе’ҢеҺҹеӣ и§ЈйҮҠдёҚеҗҲзҗҶзҡ„жҳҜ(В В В )
|
|||||||||||||||||||||
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺеҗ„еӣҫзҡ„еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ(В В В )
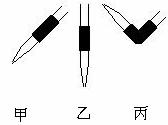
AпјҺеӣҫз”ІиЎЁзӨәl mol H2(g)е®Ңе…ЁзҮғзғ§з”ҹжҲҗж°ҙи’ёж°”еҗёж”¶241пјҺ8 BпјҺеӣҫз”ІиЎЁзӨә2 mol H2(g)жүҖе…·жңүзҡ„иғҪйҮҸжҜ”2 mol H2O(g)жүҖе…·жңүзҡ„иғҪйҮҸеӨҡ483.6 kJ CпјҺеӣҫд№ҷиЎЁзӨәеёёжё©дёӢзЁҖйҮҠHAгҖҒHBдёӨз§Қй…ёзҡ„еӣҫеғҸпјҢеҫ—еҮәз»“и®әпјҡHAзҡ„й…ёжҖ§еӨ§дәҺHBзҡ„й…ёжҖ§ DпјҺеӣҫд№ҷдёӯиө·е§Ӣж—¶HAзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰеӨ§дәҺHB
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
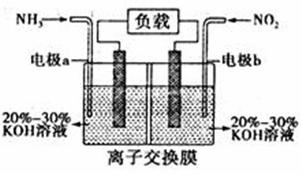
д»ҘN2е’ҢH2дёәеҸҚеә”зү©гҖҒжә¶жңүAзҡ„зЁҖзӣҗй…ёдёәз”өи§ЈиҙЁжә¶ж¶ІпјҢеҸҜеҲ¶жҲҗиғҪеӣәж°®зҡ„ж–°еһӢзҮғж–ҷз”өжұ пјҢеҺҹзҗҶеҰӮдёӢеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ (В В В )В В
A. bз”өжһҒдёәиҙҹжһҒпјҢеҸ‘з”ҹж°§еҢ–еҸҚеә” B. aз”өжһҒеҸ‘з”ҹзҡ„еҸҚеә”дёәN2+8H++6e-=2NH4+ C. Aжә¶ж¶ІдёӯжүҖеҗ«жә¶иҙЁдёәNH4Cl D. еҪ“еҸҚеә”ж¶ҲиҖ—1mol N2ж—¶пјҢеҲҷж¶ҲиҖ—зҡ„H2дёә67.2L
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү A.зҰ»еӯҗеҢ–еҗҲзү©дёҖе®ҡеҗ«жңүзҰ»еӯҗй”®пјҢеҸҜиғҪеҗ«жңүжһҒжҖ§й”®е’ҢйқһжһҒжҖ§й”®пјӣ B.ејәз”өи§ЈиҙЁзҡ„ж°ҙжә¶ж¶ІдёҖе®ҡиғҪеҜјз”өпјӣйқһз”өи§ЈиҙЁзҡ„ж°ҙжә¶ж¶ІдёҖе®ҡдёҚеҜјз”өпјӣ C.жө“еәҰзӣёеҗҢж—¶пјҢејәз”өи§ЈиҙЁзҡ„ж°ҙжә¶ж¶Ізҡ„еҜјз”өжҖ§дёҖе®ҡжҜ”ејұз”өи§ЈиҙЁејәпјӣ D.зӣёеҗҢжқЎд»¶дёӢпјҢpHзӣёеҗҢзҡ„зӣҗй…ёе’ҢйҶӢй…ёзҡ„
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
дёҖе®ҡжё©еәҰдёӢпјҢдҪ“з§Ҝдёә2 Lзҡ„еҜҶй—ӯе®№еҷЁдёӯXгҖҒYгҖҒZдёүз§Қж°”дҪ“зҡ„еҲқе§Ӣзү©иҙЁзҡ„йҮҸе’Ңе№іиЎЎзү©иҙЁзҡ„йҮҸеҰӮдёӢиЎЁпјҡ
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺеҸҚеә”еҸҜиЎЁзӨәдёә2XпјӢ3Y BпјҺеўһеӨ§еҺӢејәдҪҝе№іиЎЎеҗ‘з”ҹжҲҗZзҡ„ж–№еҗ‘移еҠЁпјҢе№іиЎЎеёёж•°еўһеӨ§ CпјҺиӢҘе°Ҷе®№еҷЁзҡ„дҪ“з§ҜеҺӢзј©иҮі1 LпјҢеҲҷXзҡ„дҪ“з§ҜеҲҶж•°еҮҸе°ҸпјҢжө“еәҰеўһеӨ§ DпјҺиӢҘеҚҮй«ҳжё©еәҰж—¶пјҢZзҡ„жө“еәҰеўһеӨ§пјҢеҸҜзҹҘжё©еәҰеҚҮй«ҳж—¶жӯЈеҸҚеә”йҖҹзҺҮеўһеӨ§пјҢйҖҶеҸҚеә”йҖҹзҺҮеҮҸе°ҸпјҢе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ
|
|||||||||||||
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж“ҚдҪңдёӯпјҢиғҪдҪҝз”өзҰ»е№іиЎЎH2O AпјҺеҗ‘ж°ҙдёӯеҠ е…ҘNaHSO4жә¶ж¶ІВ В В В В В В В В В В В BпјҺеҗ‘ж°ҙдёӯеҠ е…ҘAl2(SO4)3еӣәдҪ“ CпјҺеҗ‘ж°ҙдёӯеҠ е…ҘNa2CO3жә¶ж¶І В В В В В В В В В В В DпјҺе°Ҷж°ҙеҠ зғӯеҲ°100в„ғпјҢдҪҝpHпјқ6
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺз”өи§ЈиҙЁжә¶ж¶Ізҡ„еҸҷ AпјҺеёёжё©дёӢпјҢpHпјқ7зҡ„NH4ClдёҺж°Ёж°ҙзҡ„ж··еҗҲжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰеӨ§е°ҸйЎәеәҸдёә
BпјҺе°ҶpHпјқ4зҡ„йҶӢй…ёжә¶ж¶ІзЁҖйҮҠеҗҺпјҢжә¶ж¶ІдёӯжүҖжңүзҰ»еӯҗзҡ„жө“еәҰеқҮйҷҚдҪҺ CпјҺдёӯе’ҢpHдёҺдҪ“з§ҜеқҮзӣёеҗҢзҡ„зӣҗй…ёе’ҢйҶӢй…ёжә¶ж¶ІпјҢж¶ҲиҖ—NaOHзҡ„зү©иҙЁзҡ„йҮҸзӣёеҗҢ DпјҺеёёжё©дёӢпјҢеҗҢжө“еәҰзҡ„Na2SдёҺNaHSжә¶ж¶ІзӣёжҜ”пјҢNa2Sжә¶ж¶Ізҡ„pHеӨ§
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDдёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹе…ғзҙ гҖӮе·ІзҹҘAзҡ„жҹҗз§ҚеҚ•иҙЁжҳҜиҮӘ然з•ҢдёӯзЎ¬еәҰжңҖеӨ§зҡ„зү©иҙЁпјҢCе…ғзҙ жҳҜзҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ дёӯеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„е…ғзҙ пјҢaдёәAзҡ„жңҖй«ҳд»·ж°§еҢ–зү©пјҢbгҖҒcгҖҒdеҲҶеҲ«дёәBгҖҒCгҖҒDзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©гҖӮеҢ–е’Ңзү©aпҪһgзҡ„иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨә(йғЁеҲҶдә§зү©е·ұз•ҘеҺ»)гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
A. з®ҖеҚ•зҰ»еӯҗеҚҠеҫ„зҡ„еӨ§е°ҸпјҡC>D>B B. aдёӯеҸӘеҗ«йқһжһҒжҖ§е…ұд»·й”®пјҢеұһдәҺе…ұд»·еҢ–еҗҲзү© C. Bзҡ„ж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§е’ҢжІёзӮ№еқҮеӨ§дәҺAзҡ„ж°ўеҢ–зү© D. е·ҘдёҡдёҠйҖҡиҝҮз”өи§Је…¶
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYгҖҒZдёәдёүз§Қж°”дҪ“пјҢжҠҠa mol Xе’Ңb mol Yе……е…ҘдёҖеҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”X + 2Y AгҖҒ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз»ҷе®ҡзҡ„еӣӣз§Қжә¶ж¶ІдёӯпјҢеҠ е…Ҙд»ҘдёӢеҗ„з§ҚзҰ»еӯҗпјҢеҗ„зҰ»еӯҗиғҪеңЁеҺҹжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„жңүпјҲВ В пјү A. ж»ҙеҠ зҹіи•ҠиҜ•ж¶ІжҳҫзәўиүІзҡ„жә¶ж¶ІпјҡFe3+гҖҒNH4+гҖҒCl-гҖҒI- B. pHеҖјдёә1зҡ„жә¶ж¶ІпјҡCu2+гҖҒNa+гҖҒMg2+гҖҒNO3- C. ж°ҙз”өзҰ»еҮәжқҘзҡ„c(H+)=10пјҚ13mol/Lзҡ„жә¶ж¶ІпјҡK+гҖҒHCO3-гҖҒBr-гҖҒBa2+ D. жүҖеҗ«жә¶иҙЁдёәNa2SO4зҡ„жә¶ж¶Іпјҡ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖеҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ1molCOе’Ң1molH2OпјҲgпјүВӯпјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҡCOпјҲgпјү+H2OпјҲgпјү A.0.9molВ В В В В В В В B.0.8molВ В В В В В В В В В В C.0.7molВ В В В В В В D.2.50molВ В В
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖжҒ’е®№зҡ„е®№еҷЁдёӯе……е…Ҙ2 mol Aе’Ң1 mol BпјҢеҸ‘з”ҹеҸҚеә” 2A(g) + B(g)В Aдёә0.6 molпјҢBдёә0.3 molпјҢCдёә1.4 molе……е…Ҙе®№еҷЁпјҢиҫҫеҲ°е№іиЎЎеҗҺпјҢCзҡ„дҪ“з§ҜеҲҶж•°д»ҚдёәW%пјҢеҲҷxзҡ„еҖјдёә пјҲВ В В пјүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺеҸӘиғҪдёә2В В В В BпјҺеҸӘиғҪдёә3В В В В CпјҺеҸҜиғҪжҳҜ2пјҢд№ҹеҸҜиғҪжҳҜ3В В В В В DпјҺж— жі•зЎ®е®ҡ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠж°ҜеҢ–дәҡй“Ғжә¶ж¶Іи’ёе№ІзҒјзғ§пјҢжңҖеҗҺеҫ—еҲ°зҡ„еӣәдҪ“дә§зү©жҳҜ пјҲВ пјү В AпјҺж— ж°ҙдёүж°ҜеҢ–й“ҒгҖҖгҖҖгҖҖгҖҖBпјҺж°ўж°§еҢ–й“Ғ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еӣҫзӨәдёҺеҜ№еә”еҸҷиҝ°зӣёз¬ҰеҗҲзҡ„жҳҜпјҲВ В В пјү
AпјҺеӣҫIпјҡеҸҚеә”N2+3H2 BпјҺеӣҫв…ЎпјҡеҸҚеә”H2+I2 CпјҺеӣҫIIIпјҡеҸҚеә”CO2(g)+H2(g) DпјҺеӣҫIVпјҡеҸҚеә”2SO2пјӢO2
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжё©еәҰдёӢпјҢеңЁдёҖдёӘдҪ“з§Ҝеӣәе®ҡзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢе……е…Ҙ2 mol NOе’Ң1 molO2пјҢ еҸ‘з”ҹеҸҚеә”пјҡ2NO(g) пјӢO2(g) A.11вҲ¶15В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺе°ҸдәҺ11вҲ¶15В В В В В CпјҺ5вҲ¶6 В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺеӨ§дәҺ5вҲ¶6
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ1 L 0.2 molВ·L-1NaOHжә¶ж¶ІдёӯйҖҡе…Ҙж ҮеҮҶзҠ¶еҶөдёӢзҡ„CO24.48 LпјҢе®Ңе…ЁеҸҚеә”еҗҺпјҢеҲҷдёӢеҲ—е…ізі»ејҸдёӯжӯЈзЎ®зҡ„жҳҜпјҲгҖҖпјү
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжё©еәҰдёӢпјҢеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ2A(g)+B(g) AпјҺ3 mol CВ В В В В В В В В В В В В В В В В В BпјҺ2 mol AгҖҒ3 mol Bе’Ң1 mol HeпјҲдёҚеҸӮеҠ еҸҚеә”пјү CпјҺ1 mol Bе’Ң1 mol CВ В В В В В В В DпјҺ2 mol AгҖҒ3 mol Bе’Ң3 mol C
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
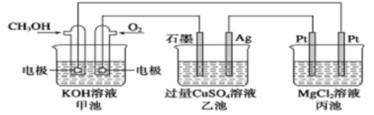
еҰӮдёӢеӣҫжүҖзӨәпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В В )
AпјҺз”Іжұ жҳҜз”өиғҪиҪ¬еҢ–дёәеҢ–еӯҰиғҪзҡ„иЈ…зҪ®пјҢд№ҷгҖҒдёҷжұ жҳҜеҢ–еӯҰиғҪиҪ¬еҢ–з”өиғҪзҡ„иЈ…зҪ® BпјҺз”Іжұ йҖҡе…ҘCH3OHзҡ„з”өжһҒеҸҚеә”ејҸдёәCH3OHпјҚ6eпјҚпјӢ2H2O===CO32-пјӢ8HпјӢ CпјҺеҸҚеә”дёҖж®өж—¶й—ҙеҗҺпјҢеҗ‘д№ҷжұ DпјҺз”Іжұ дёӯж¶ҲиҖ—280 mL(ж ҮеҮҶзҠ¶еҶөдёӢ)O2пјҢжӯӨж—¶дёҷжұ дёӯзҗҶи®әдёҠжңҖеӨҡдә§з”ҹ1.45gеӣәдҪ“
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
В е·ІзҹҘNaHSO3жә¶ж¶Іжҳҫй…ёжҖ§,жә¶ж¶ІдёӯеӯҳеңЁд»ҘдёӢе№іиЎЎ: HSO3-+H2O HSO3- еҗ‘0.1 molВ·L-1зҡ„NaHSO3жә¶ж¶ІдёӯеҲҶеҲ«еҠ е…Ҙд»ҘдёӢзү©иҙЁ,дёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.еҠ е…Ҙж°Ёж°ҙиҮідёӯжҖ§,еҲҷ2c(Na+)=c(SO32-)>c(H+)=c(OH-) B.еҠ е…Ҙе°‘йҮҸNaOHжә¶ж¶І, C.еҠ е…Ҙе°‘йҮҸN D.еҠ е…Ҙе°‘йҮҸйҮ‘еұһNa,е№іиЎЎв‘ е·Ұ移,е№іиЎЎв‘ЎеҸіз§»,жә¶ж¶Ідёӯc(HSO3-)еўһеӨ§
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
|
е®һйӘҢе®ӨдёӯжңүдёҖжңӘзҹҘжө“еәҰзҡ„зЁҖзӣҗй…ёпјҢжҹҗеӯҰз”ҹдёәжөӢе®ҡзӣҗй…ёзҡ„жө“еәҰеңЁе®һйӘҢе®ӨдёӯиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡиҜ·е®ҢжҲҗдёӢеҲ—еЎ«з©әпјҡ (1) й…ҚеҲ¶100mL 0.1000mol/L NaOHж ҮеҮҶжә¶ж¶ІгҖӮ В (2) еҸ–20.00mLеҫ…жөӢзЁҖзӣҗй…ёжә¶ж¶Іж”ҫе…Ҙй”ҘеҪўз“¶дёӯпјҢ并ж»ҙеҠ 2пҪһ3ж»ҙй…ҡй…һдҪңжҢҮзӨәеүӮпјҢз”ЁиҮӘе·ұй…ҚеҲ¶зҡ„ж ҮеҮҶNaOHжә¶ж¶ІиҝӣиЎҢж»ҙе®ҡгҖӮйҮҚеӨҚдёҠиҝ°ж»ҙе®ҡж“ҚдҪң2пҪһ3ж¬ЎпјҢи®°еҪ•ж•°жҚ®еҰӮдёӢгҖӮ
в‘ ж»ҙе®ҡиҫҫеҲ°з»ҲзӮ№зҡ„зҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮжӯӨж—¶й”ҘеҪўз“¶еҶ…жә¶ж¶Ізҡ„pHдёәВ В В В В В В гҖӮ в‘Ўж №жҚ®дёҠиҝ°ж•°жҚ®пјҢеҸҜи®Ўз®—еҮәиҜҘзӣҗй…ёзҡ„жө“еәҰзәҰдёәВ В В В В В В пјҲдҝқз•ҷеӣӣдҪҚжңүж•Ҳж•°еӯ—пјү
в‘ЈеңЁдёҠиҝ°е®һйӘҢдёӯпјҢдёӢеҲ—ж“ҚдҪңпјҲе…¶д»–ж“ҚдҪңжӯЈзЎ®пјүеҲҶеҲ«еҜ№жөӢе®ҡз»“жһңйҖ жҲҗд»Җд№ҲеҪұе“ҚпјҹпјҲеЎ«вҖңеҒҸдҪҺвҖқгҖҒвҖңеҒҸй«ҳвҖқгҖҒвҖңж— еҪұе“ҚвҖқпјү AпјҺж»ҙе®ҡз»ҲзӮ№иҜ»ж•°ж—¶дҝҜи§ҶиҜ»ж•° В В В В В В В В BпјҺй…ёејҸж»ҙе®ҡз®ЎдҪҝз”ЁеүҚпјҢж°ҙжҙ—еҗҺжңӘз”Ёеҫ…жөӢзӣҗй…ёжә¶ж¶Іж¶Ұжҙ—В В В В В В В CпјҺй”ҘеҪўз“¶ж°ҙжҙ—еҗҺжңӘе№ІзҮҘВ В В В В В В В В DпјҺз§°йҮҸеүҚNaOHеӣәдҪ“дёӯж··жңүNa2CO3еӣәдҪ“В В В В В В В В В EпјҺзўұејҸж»ҙе®ҡз®Ўе°–еҳҙйғЁеҲҶжңүж°”жіЎпјҢж»ҙе®ҡеҗҺж¶ҲеӨұВ В В В В В В В В
|
|||||||||||||||||
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°Ёзҡ„еҗҲжҲҗеҜ№еӣҪ家е·ҘдёҡеҸ‘еұ•жңүзқҖдёҫи¶іиҪ»йҮҚзҡ„дҪңз”ЁпјҢиҜ·ж №жҚ®еҢ–еӯҰеҺҹзҗҶзҹҘиҜҶеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүе·ІзҹҘж°ўж°”зҡ„зҮғзғ§зғӯдёә285.8kJ/molгҖӮ 4NH3 (g) +5O2 (g) N2пјҲgпјү+ O2пјҲgпјүв•җ 2NOпјҲgпјүв–іH = +180.6kJ/molгҖӮ еҲҷе·ҘдёҡеҗҲжҲҗж°Ёзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүжҹҗз§‘з ”е°Ҹз»„з ”з©¶пјҡеңЁе…¶д»–жқЎд»¶дёҚеҸҳзҡ„жғ…еҶөдёӢпјҢж”№еҸҳиө·е§Ӣзү©ж°ўж°”зҡ„зү©иҙЁзҡ„йҮҸеҜ№N2(g)+3H2(g)
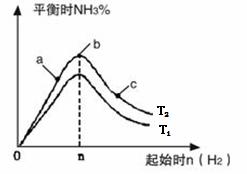
в‘ еӣҫеғҸдёӯ T2е’Ң T1зҡ„е…ізі»жҳҜпјҡ T2 В В В В T1пјҲеЎ«вҖңй«ҳдәҺвҖқгҖҒвҖңдҪҺдәҺвҖқгҖҒ вҖңзӯүдәҺвҖқжҲ–вҖңж— жі•зЎ®е®ҡвҖқпјүгҖӮ в‘ЎжҜ”иҫғеңЁaгҖҒbгҖҒcдёүзӮ№жүҖеӨ„зҡ„е№іиЎЎзҠ¶жҖҒдёӯпјҢеҸҚеә”зү©N 2 зҡ„иҪ¬еҢ–зҺҮжңҖй«ҳзҡ„жҳҜ В В В В В В пјҲеЎ«еӯ—жҜҚпјүгҖӮ в‘ўеңЁиө·е§ӢдҪ“зі»дёӯn(N2)пјҡn(H2)= 1:3ж—¶пјҢеҸҚеә”еҗҺж°Ёзҡ„зҷҫеҲҶеҗ«йҮҸжңҖеӨ§пјӣиӢҘе®№еҷЁе®№з§Ҝдёә1LпјҢ n=3molеҸҚеә”иҫҫеҲ°е№іиЎЎж—¶H2зҡ„иҪ¬еҢ–зҺҮдёә60%пјҢеҲҷжӯӨжқЎд»¶дёӢпјҲ T 2пјүпјҢеҸҚеә”зҡ„е№іиЎЎеёёж•° K= В В В В В В гҖӮ пјҲ3пјүж°®е…ғзҙ зҡ„+4д»·ж°§еҢ–зү©жңүдёӨз§ҚпјҢе®ғ们д№Ӣй—ҙеҸ‘з”ҹеҸҚеә”пјҡ2NO2
AпјҺbзӮ№зҡ„ж“ҚдҪңжҳҜеҺӢзј©жіЁе°„еҷЁ BпјҺcзӮ№дёҺaзӮ№зӣёжҜ”пјҢ c(NO2)еўһеӨ§пјҢ c(N2O4)еҮҸе°Ҹ CпјҺиӢҘдёҚеҝҪз•ҘдҪ“зі»жё©еәҰеҸҳеҢ–пјҢдё”жІЎжңүиғҪйҮҸжҚҹеӨұпјҢеҲҷbгҖҒcдёӨзӮ№зҡ„е№іиЎЎеёёж•°Kb>Kc DпјҺdзӮ№пјҡv(жӯЈ)> v(йҖҶ) пјҲ4пјүеҲ©з”ЁеҸҚеә”6NO2+8NH3=7N2+12H2Oжһ„жҲҗеҺҹз”өжұ пјҢиғҪж¶ҲйҷӨж°®ж°§еҢ–зү©зҡ„жҺ’ж”ҫпјҢеҮҸиҪ»зҺҜеўғжұЎжҹ“пјҢиЈ…зҪ®еҰӮеӣҫжүҖзӨәгҖӮ
в‘ з”өжһҒaдёә В В В В В жһҒпјҢе…¶з”өжһҒеҸҚеә”ејҸдёә В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЎеҪ“жңү0.1 mol NO2иў«еӨ„зҗҶж—¶пјҢиҪ¬з§»з”өеӯҗдёәВ В В В В В В В В В В В В В В molгҖӮ в‘ўдёәдҪҝз”өжұ жҢҒз»ӯж”ҫз”өпјҢиҜҘзҰ»еӯҗдәӨжҚўиҶңйңҖйҖүз”ЁВ В В В В В В В В В В В В В дәӨжҚўиҶңгҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүе°Ҷ0.15 molВ·L-1зЁҖзЎ«й…ёV1mLгҖӮдёҺ0.1molВ·L-1 NaOHжә¶ж¶ІV2 mIпјҢж··еҗҲпјҢжүҖеҫ—жә¶ж¶Ізҡ„pHдёә1пјҢеҲҷV1пјҡV2пјқ В В В В В В В В В В гҖӮпјҲжә¶ж¶ІдҪ“з§ҜеҸҳеҢ–еҝҪз•ҘдёҚи®Ўпјү пјҲ2пјүе®Өжё©дёӢпјҢжҹҗж°ҙжә¶ж¶ІдёӯеҸӘеӯҳеңЁдёӢеҲ—еӣӣз§ҚзҰ»еӯҗпјҡNa+гҖҒA-гҖҒH+гҖҒ0H-пјҢжҚ®йўҳж„ҸпјҢеӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ в‘ иӢҘз”ұ0пјҺ1 molВ·L-1 HAжә¶ж¶ІдёҺ0.1 molВ·L-1 NaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲиҖҢеҫ—пјҢеҲҷжә¶ж¶Ізҡ„pH В В В В В В 7пјҲеЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүпјӣ в‘ЎиӢҘжә¶ж¶ІpH>7пјҢеҲҷcпјҲNa+пјү В В В В В В В В В В В В cпјҲA-пјүпјҲеЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүпјҢ зҗҶз”ұжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ўиӢҘз”ұpHпјқ3зҡ„HAжә¶ж¶ІV1mLдёҺpHпјқ11зҡ„NaOH{жә¶ж¶ІV2 mLгҖӮж··еҗҲиҖҢеҫ—пјҢеҲҷдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ В В В В В В В В гҖӮ AпјҺиӢҘеҸҚеә”еҗҺжә¶ж¶Іе‘ҲдёӯжҖ§ BпјҺиӢҘV1=V2пјҢеҸҚеә”еҗҺжә¶ж¶ІpHдёҖе®ҡзӯүдәҺ7 CпјҺиӢҘеҸҚеә”еҗҺжә¶ж¶Іе‘Ҳй…ёжҖ§пјҢеҲҷV1дёҖе®ҡеӨ§дәҺV2 DпјҺиӢҘеҸҚеә”еҗҺжә¶ж¶Іе‘ҲзўұжҖ§пјҢеҲҷV1дёҖе®ҡе°ҸдәҺV2
|
|
- 2019еұҠй«ҳдёү9жңҲжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲеӣӣе·қзңҒжҲҗйғҪеёӮйҫҷжіү第дәҢдёӯеӯҰпјү
- 2017-2018е№ҙй«ҳдёҖеүҚеҚҠжңҹеҚҠжңҹиҖғиҜ•еҢ–еӯҰиҖғеҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲеӣӣе·қзңҒзҹіе®ӨдёӯеӯҰпјү
- й«ҳдёӯеҢ–еӯҰдәәж•ҷзүҲ еҝ…дҝ®2 第еӣӣз« еҢ–еӯҰдёҺиҮӘ然иө„жәҗзҡ„ејҖеҸ‘еҲ©з”Ё 第дәҢиҠӮ иө„жәҗз»јеҗҲз®ЎзҗҶ зҺҜеўғдҝқжҠӨ з…ӨгҖҒзҹіжІ№гҖҒеӨ©з„¶ж°”зҡ„з»јеҗҲеҲ©з”Ё
- 2017-2018е№ҙй«ҳдәҢ12жңҲжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢпјҲдә‘еҚ—зңҒеҚ—涧еҺҝж°‘ж—ҸдёӯеӯҰпјү
- 2017-2018е№ҙй«ҳдёҖ12жңҲеӯҰз”ҹеӯҰдёҡиғҪеҠӣи°ғз ”иҖғиҜ•еҢ–еӯҰиҖғиҜ•йўҳпјҲеӨ©жҙҘеёӮйқҷжө·еҺҝ第дёҖдёӯеӯҰпјү
- жҫ„еҹҺеҺҝеҹҺе…ідёӯеӯҰ2019е№ҙй«ҳдәҢдёҠеҶҢеҢ–еӯҰжңҲиҖғжөӢйӘҢеёҰзӯ”жЎҲдёҺи§Јжһҗ
- й«ҳдёӯеҢ–еӯҰдәәж•ҷзүҲ йҖүдҝ®дә” 第дәҢз« з¬¬дёҖиҠӮ зӮ”зғғ
- 2017-2018е№ҙй«ҳдәҢдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғеҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲиҫҪе®ҒзңҒжІҲйҳіеёӮдёңеҢ—иӮІжүҚеӯҰж Ўпјү


 В
В 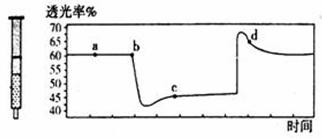 В
В