2017й»‘йҫҷжұҹй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе…ғзҙ зҡ„еҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫдёәпјҡ A. 第дәҢе‘ЁжңҹпјҢз¬¬в… Aж—ҸВ В В B. 第дәҢе‘ЁжңҹпјҢ第в…ӨAж—Ҹ C. 第дёүе‘ЁжңҹпјҢ第ⅣAж—ҸВ В В D. 第дёүе‘ЁжңҹпјҢ第в…ӨAж—Ҹ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—еҺҹеӯҗдёӯпјҢжңҖе®№жҳ“еҪўжҲҗйҳізҰ»еӯҗзҡ„жҳҜпјҲгҖҖгҖҖпјү A. C.
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҖ’еҸҳ规еҫӢдёҚжӯЈзЎ®зҡ„жҳҜ A. NaгҖҒMgгҖҒAlиҝҳеҺҹжҖ§дҫқж¬ЎеҮҸејұВ В В B. I2гҖҒBr2гҖҒCl2ж°§еҢ–жҖ§дҫқж¬Ўеўһејә C. FгҖҒClгҖҒBrгҖҒIеҺҹеӯҗеҚҠеҫ„дҫқж¬ЎеўһеӨ§В В В D. NгҖҒOгҖҒFжңҖй«ҳжӯЈд»·дҫқж¬ЎеҚҮй«ҳ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
иҝ‘е№ҙжқҘпјҢе…үеҢ–еӯҰзғҹйӣҫжұЎжҹ“й—®йўҳе·Іеј•иө·дәә们зҡ„жіЁж„ҸпјҢдёӢеҲ—е“Әз§Қж°”дҪ“жҳҜйҖ жҲҗе…үеҢ–еӯҰзғҹйӣҫзҡ„жңҖдё»иҰҒеӣ зҙ (В В В В ) A. NO2В В В B. SO2 C. COВ В В D. CH4
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
В е°Ҷе°‘йҮҸзҡ„CO2йҖҡе…ҘдёӢеҲ—жә¶ж¶ІдёӯпјҢдёҚиғҪдә§з”ҹжІүж·Җзҡ„жҳҜ(В В В В ) A. зЎ…й…ёй’ жә¶ж¶ІВ В В B. зҹізҒ°ж°ҙ C. ж°ўж°§еҢ–й’Ўжә¶ж¶ІВ В В D. ж°ҜеҢ–й’ҷжә¶ж¶І
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
В иҮӘжқҘж°ҙеҸҜз”Ёж°Ҝж°”ж¶ҲжҜ’пјҢжҹҗеӯҰз”ҹз”Ёиҝҷз§ҚиҮӘжқҘж°ҙеҺ»й…ҚеҲ¶дёӢеҲ—зү©иҙЁжә¶ж¶ІпјҢдјҡдә§з”ҹжҳҺжҳҫзҡ„иҚҜе“ҒеҸҳиҙЁй—®йўҳзҡ„жҳҜ(В В В В ) A. NaNO3В В В B. FeCl2 C. Na2SO4В В В D. AlCl3
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
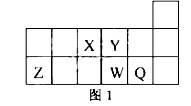
зҹӯе‘Ёжңҹе…ғзҙ XгҖҒYгҖҒZгҖҒWгҖҒQеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„зӣёеҜ№дҪҚзҪ®еҰӮеӣҫ1жүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
A. е…ғзҙ XдёҺе…ғзҙ Zзҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·д№Ӣе’Ңзҡ„ж•°еҖјзӯүдәҺ8 B. еҺҹеӯҗеҚҠеҫ„зҡ„еӨ§е°ҸйЎәеәҸдёәпјҡrXпјһrYпјһrZпјһrWпјһrQ C. зҰ»еӯҗY2пјҚе’ҢZ 3пјӢзҡ„ж ёеӨ–з”өеӯҗж•°е’Ңз”өеӯҗеұӮж•°йғҪдёҚзӣёеҗҢ D. е…ғзҙ Wзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„й…ёжҖ§жҜ”Qзҡ„ејә
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
В SO2е’ҢCl2йғҪе…·жңүжјӮзҷҪжҖ§пјҢиӢҘе°Ҷзӯүзү©иҙЁзҡ„йҮҸзҡ„иҝҷдёӨз§Қж°”дҪ“еҗҢж—¶дҪңз”ЁдәҺжҪ®ж№ҝзҡ„жңүиүІзү©иҙЁпјҢеҸҜи§ӮеҜҹеҲ°жңүиүІзү©иҙЁ(В В В В ) A. з«ӢеҲ»иӨӘиүІВ В В B. ж…ўж…ўиӨӘиүІ C. е…ҲиӨӘиүІпјҢеҗҺеӨҚеҺҹВ В В D. йўңиүІдёҚиӨӘ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
В дҫқжҚ®е…ғзҙ е‘ЁжңҹиЎЁеҸҠе…ғзҙ е‘ЁжңҹеҫӢпјҢдёӢеҲ—жҺЁж–ӯжӯЈзЎ®зҡ„жҳҜ A. H3BO3зҡ„й…ёжҖ§жҜ”H2CO3зҡ„ејә B. Mg(OH)2зҡ„зўұжҖ§жҜ”Be(OH)2зҡ„ејә C. HClгҖҒHBrгҖҒHIзҡ„зғӯзЁіе®ҡжҖ§дҫқж¬Ўеўһејә D. иӢҘMпјӢе’ҢR2пјҚзҡ„ж ёеӨ–з”өеӯҗеұӮз»“жһ„зӣёеҗҢпјҢеҲҷеҺҹеӯҗеәҸж•°пјҡRпјһM
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺдёӢеҲ—дәӢе®һзҡ„и§ЈйҮҠй”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ) A. еңЁи”—зі–дёӯеҠ е…Ҙжө“зЎ«й…ёеҗҺеҮәзҺ°еҸ‘й»‘зҺ°иұЎпјҢиҜҙжҳҺжө“зЎ«й…ёе…·жңүи„ұж°ҙжҖ§ B. жө“зЎқй…ёеңЁе…үз…§дёӢйўңиүІеҸҳй»„пјҢиҜҙжҳҺжө“зЎқй…ёдёҚзЁіе®ҡ C. еёёжё©дёӢпјҢжө“зЎқй…ёеҸҜд»Ҙз”Ёй“қзҪҗиҙ®еӯҳпјҢиҜҙжҳҺй“қдёҺжө“зЎқй…ёдёҚеҸҚеә” D. жө“зЎ«й…ёеёёжё©дёӢдёҺй“ңдёҚеҸҚеә”пјҢеҠ зғӯж—¶жүҚиғҪеҸ‘з”ҹеҸҚеә”
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺзЎ…еҚ•иҙЁеҸҠе…¶еҢ–еҗҲзү©зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ в‘ зЎ…жҳҜжһ„жҲҗдёҖдәӣеІ©зҹіе’Ңзҹҝзү©зҡ„еҹәжң¬е…ғзҙ в‘Ўж°ҙжіҘгҖҒзҺ»з’ғгҖҒж°ҙжҷ¶йҘ°зү©йғҪжҳҜзЎ…й…ёзӣҗеҲ¶е“Ғ в‘ўй«ҳзәҜеәҰзҡ„зЎ…еҚ•иҙЁе№ҝжіӣз”ЁдәҺеҲ¶дҪңе…үеҜјзәӨз»ҙ в‘Јйҷ¶з“·жҳҜдәәзұ»еә”з”ЁеҫҲж—©зҡ„зЎ…й…ёзӣҗжқҗж–ҷ A. в‘ в‘ЎВ В В B. в‘Ўв‘ўВ В В C. в‘ в‘ЈВ В В D. в‘ўв‘Ј
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
В еҲӨж–ӯдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ пјҲВ В В пјү A. NO2жә¶дәҺж°ҙж—¶еҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә” B. COгҖҒNOгҖҒNO2йғҪжҳҜеӨ§ж°”жұЎжҹ“ж°”дҪ“пјҢеңЁз©әж°”дёӯйғҪиғҪзЁіе®ҡеӯҳеңЁ C. NOеҸҜз”ЁдәҺжҹҗдәӣз–ҫз—…зҡ„жІ»з–— D. NO2дёҺж°ҙзҡ„еҸҚеә”пјҡ3NO2пјӢH2O===2NO
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—зү©иҙЁиғҪйҖҡиҝҮеҢ–еҗҲеҸҚеә”зӣҙжҺҘеҲ¶еҫ—зҡ„жҳҜ(гҖҖгҖҖ) в‘ FeCl2гҖҖв‘ЎFeпјҲOHпјү3гҖҖв‘ўNH4NO3гҖҖв‘ЈHCl A. еҸӘжңүв‘ в‘Ўв‘ўВ В В B. еҸӘжңүв‘Ўв‘ў C. еҸӘжңүв‘ в‘ўв‘ЈВ В В D. е…ЁйғЁ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. й’ зҡ„йҮ‘еұһжҙ»жіјжҖ§еӨ§дәҺй“ңпјҢеңЁжә¶ж¶Ідёӯй’ еҸҜд»ҘзҪ®жҚўеҮәй“ң B. Na2O2дёҺж°ҙеҸҚеә”пјҢзәўзғӯзҡ„FeдёҺж°ҙи’ёж°”еҸҚеә”еқҮиғҪз”ҹжҲҗж°”дҪ“ C. зўігҖҒй’ дёҺO2еҸҚеә”ж—¶пјҢз”ұдәҺO2зҡ„йҮҸдёҚеҗҢпјҢеҸҜеҲҶеҲ«з”ҹжҲҗCOгҖҒCO2е’ҢNa2OгҖҒNa2O2 D. е·ҘдёҡдёҠз”өи§ЈзҶ”иһҚMgCl2еҲ¶еҸ–й•ҒпјҢд№ҹеҸҜз”өи§ЈзҶ”иһҚAlCl3еҲ¶еҸ–й“қ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. е°Ҷж°Ёж°ҙж»ҙе…ҘеҲ°FeCl3жә¶ж¶ІдёӯпјҡFe3пјӢпјӢ3OHпјҚ===Fe(OH)3вҶ“ B. ж°§еҢ–й“ҒдёҺзӣҗй…ёеҸҚеә”пјҡFe2O3пјӢ6HпјӢ===2Fe3пјӢпјӢ3H2O C. еҗ‘FeCl3жә¶ж¶ІдёӯеҠ е…Ҙй“ҒзІүпјҡFeпјӢFe3пјӢ===2Fe2пјӢ D. еҗ‘ж°ҜеҢ–дәҡй“Ғжә¶ж¶ІдёӯйҖҡе…ҘCl2пјҡFe2пјӢпјӢCl2===Fe3пјӢпјӢ2ClпјҚ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ33AsгҖҒ35BrдҪҚдәҺеҗҢдёҖе‘ЁжңҹпјҢдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. еҺҹеӯҗеҚҠеҫ„пјҡAsпјһC1пјһPВ В В B. зғӯзЁіе®ҡжҖ§пјҡHC1пјһAsH3пјһHBr C. иҝҳеҺҹжҖ§пјҡAs3вҲ’пјһS2вҲ’пјһC1вҲ’В В В D. й…ёжҖ§пјҡH3AsO4пјһH2SO4пјһH3PO4
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеұһдәҺз”өи§ЈиҙЁзҡ„жҳҜ A. йҮ‘еұһй“ңВ В В B. е№ІеҶ°В В В C. еҶ°йҶӢй…ёВ В В D. ж°Ёж°”(NH3)
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—ж №жҚ®е®һйӘҢзҺ°иұЎеҒҡеҮәзҡ„жҺЁж–ӯпјҢжӯЈзЎ®зҡ„жҳҜ(В В В В ) A. жә¶дәҺж°ҙеҗҺиғҪеҪўжҲҗж— иүІжә¶ж¶Ізҡ„зәўжЈ•иүІж°”дҪ“дёҖе®ҡжҳҜ NO B. иғҪдҪҝж№ҝж¶Ұзҡ„ж·ҖзІүзўҳеҢ–й’ҫиҜ•зәёеҸҳи“қзҡ„ж°”дҪ“дёҖе®ҡжҳҜ Cl2 C. йҒҮз©әж°”з«ӢеҚіеҪўжҲҗзәўжЈ•иүІж°”дҪ“зҡ„дёҖе®ҡжҳҜ NO D. еңЁжҪ®ж№ҝзҡ„з©әж°”дёӯеҪўжҲҗзҷҪйӣҫзҡ„ж°”дҪ“дёҖе®ҡжҳҜ HCl
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||||||
|
дёӢиЎЁжҳҜе‘ЁжңҹиЎЁдёӯзҡ„дёҖйғЁеҲҶпјҢж №жҚ®AпҪһIеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®пјҢз”Ёе…ғзҙ з¬ҰеҸ·жҲ–еҢ–еӯҰејҸеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүиЎЁдёӯе…ғзҙ пјҢеҢ–еӯҰжҖ§иҙЁжңҖдёҚжҙ»жіјзҡ„жҳҜ__________пјҢеҸӘжңүиҙҹд»·иҖҢж— жӯЈд»·зҡ„жҳҜ__________, еҸҜз”ЁдәҺеҲ¶еҚҠеҜјдҪ“жқҗж–ҷзҡ„е…ғзҙ жҳҜ_______гҖӮ пјҲ2пјүжңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зўұжҖ§жңҖејәзҡ„жҳҜ__________пјҢй…ёжҖ§жңҖејәзҡ„жҳҜ_____пјҢе‘ҲдёӨжҖ§зҡ„жҳҜ__________пјӣ пјҲ3пјүAеҲҶеҲ«дёҺDгҖҒEгҖҒFгҖҒGгҖҒHеҪўжҲҗзҡ„еҢ–еҗҲзү©дёӯпјҢжңҖзЁіе®ҡзҡ„__________пјӣ пјҲ4пјүеңЁBгҖҒCгҖҒDгҖҒJгҖҒ EгҖҒFгҖҒGгҖҒHдёӯпјҢеҺҹеӯҗеҚҠеҫ„жңҖеӨ§зҡ„жҳҜ__________гҖӮ
|
|||||||||||||||||||||||||||||||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
В пјҲ1пјүзЎ«й…ёеңЁдёӢеҲ—з”ЁйҖ”жҲ–еҸҚеә”дёӯеҗ„иЎЁзҺ°зҡ„жҖ§иҙЁжҳҜпјҲз”Ёеӯ—жҜҚеЎ«еңЁжЁӘзәҝдёҠпјү AпјҺйҡҫжҢҘеҸ‘жҖ§В BпјҺй…ёжҖ§В CпјҺеҗёж°ҙжҖ§В DпјҺи„ұж°ҙжҖ§В EпјҺејәж°§еҢ–жҖ§В FпјҺеӮ¬еҢ–дҪңз”Ё в‘ жө“зЎ«й…ёеҸҜз”ЁдҪңж°”дҪ“е№ІзҮҘеүӮ _______пјӣ в‘ЎеҫҖжҷ¶дҪ“зЎ«й…ёй“ңдёӯеҠ жө“зЎ«й…ёпјҢжҷ¶дҪ“еҸҳзҷҪ________пјӣ в‘ўжө“зЎ«й…ёдҪҝж¶Ұж№ҝи“қиүІзҹіи•ҠиҜ•зәёе…ҲеҸҳзәўеҗҺеҸҲеҸҳй»‘___________пјӣ в‘Је®һйӘҢе®ӨеҲ¶дәҢж°§еҢ–зЎ«___________пјӣ в‘Өжө“зЎ«й…ёдёҺй“ңеҸҚеә”_____________пјӣ в‘Ҙиҝҗз”Ёй“ҒеҲ¶ж§ҪиҪҰе’Ңй“қеҲ¶ж§ҪиҪҰиҝҗиҫ“жө“зЎ«й…ё___________гҖӮ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
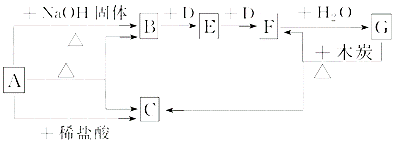
В еҰӮеӣҫиЎЁзӨәжҹҗдәӣзү©иҙЁд№Ӣй—ҙзҡ„иҪ¬еҢ–е…ізі»пјҢжҜҸдёӘеӯ—жҜҚд»ЈиЎЁдёҖз§Қзү©иҙЁпјҢйғЁеҲҶдә§зү©е·Із•ҘеҺ»гҖӮAжҳҜдёҖз§Қзўій…ёж°ўзӣҗпјҢд№ҹжҳҜдёҖз§Қеёёз”Ёзҡ„еҢ–еӯҰиӮҘж–ҷпјҢBжҳҜиғҪдҪҝж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қиүІзҡ„ж— иүІж°”дҪ“пјҢDжҳҜж— иүІж— е‘іж°”дҪ“гҖӮ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)зү©иҙЁAзҡ„еҗҚз§°жҳҜ________________гҖӮ (2)еҶҷеҮәзү©иҙЁBзҡ„дёҖз§Қдё»иҰҒз”ЁйҖ”______________гҖӮ (3)еҶҷеҮәе®һйӘҢе®ӨеҲ¶еҸ–ж°”дҪ“Bзҡ„еҢ–еӯҰж–№зЁӢејҸ__________________________гҖӮ еҶҷеҮәе·ҘдёҡдёҠеҲ¶еҸ–ж°”дҪ“Bзҡ„еҢ–еӯҰж–№зЁӢејҸ__________________________гҖӮ (4)еҶҷеҮәеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ BвҶ’E______________________________гҖӮ FвҶ’G____________________________________гҖӮ
|
|
- жөҺеҚ—еӨ–еӣҪиҜӯеӯҰж Ўдёүз®ӯеҲҶж Ўй«ҳдёҖеҢ–еӯҰ2019е№ҙеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•ж— зәёиҜ•еҚ·
- жұҹиӢҸзңҒе®ңе…ҙдёҖдёӯ2020-2021е№ҙй«ҳдёҖдёҠеҚҠжңҹ第дәҢж¬Ўйҳ¶ж®өжҖ§иҖғиҜ•еҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲ
- й«ҳдёҖдёӢеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲпјҲ2019-2020е№ҙеҗүжһ—зңҒжқҫеҺҹеёӮжү¶дҪҷеёӮ第дёҖдёӯеӯҰпјү
- 2020еұҠй«ҳдёүеҢ–еӯҰеӨ§дәҢиҪ®еўһеҲҶејәеҢ–з»ғ-- жңүжңәеҢ–еӯҰеҹәзЎҖжөҒзЁӢеӨ§йўҳ
- 2019-2020е№ҙй«ҳдәҢеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲж№–еҚ—зңҒж ӘжҙІеёӮпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеӯҰжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰпјҲй»‘йҫҷжұҹзңҒе®ҫеҺҝдёҖдёӯпјү
- зӣҳй”ҰеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•жЁЎжӢҹиҖғиҜ•з»ғд№
- 2020еұҠй«ҳдёүеҢ–еӯҰйҖүдҝ®дёүдәҢиҪ®дё“йўҳеӨҚд№ -- жҷ¶дҪ“зҡ„зӣёе…іи®Ўз®—
 В В В В D.
В В В В D.