2017陕西高二下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合来来新能源标准的是 ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
|
|
| 2. | 详细信息 |
|
下列说法正确的是 A.凡要加热才能发生的反应都是非自发进行的 B.凡是放热反应都自发的 C.自发反应都是熵增大的反应 D.吸热反应可能属于自发反应
|
|
| 3. | 详细信息 |
|
用2g块状大理石与30mL3mol/L盐酸反应制取CO2气体.若要增大反应速率,可采取的措施是 ①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸 ③改用2g粉末状大理石 ④适当升高温度 A.①②④ B.②③④ C.①③④ D.①②③
|
|
| 4. | 详细信息 |
|
将①H+、②Cl-、③A13+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+、分别加入H2O中,基本上不影响水的电离平衡的是 A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
|
|
| 5. | 详细信息 |
|
某固态化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中,―定正确的是 A.非电解质 B.弱电解质 C.离子化合物 D.易溶性盐
|
|
| 6. | 详细信息 |
|
在密闭容器中,一定条件下进行如下反应:NO (g) +CO(g) A.加催化剂同时升高温度 B.加催化剂同时增大压强 C.升高温度同时充入N2 D.降低温度同时增大压强
|
|
| 7. | 详细信息 |
|
在一定体积某浓度的Ba(NO3)2溶液中.逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是 A.10:1 B.1:10 C.9:1 D.1:9
|
|
| 8. | 详细信息 |
|
下列叙述中,不能用勒夏特列原理解释的是 A.红棕色的NO2,加压后颜色先变深后变浅 B.高压比常压有利于合成SO3的反应 C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 D.黄绿色的氯水光照后颜色变浅
|
|
| 9. | 详细信息 |
|
室溫下,向0.1 mol/L氨水中逐滴加入盐酸,下列描述不正确的是 A.pH逐渐减小 B.
|
|
| 10. | 详细信息 |
|
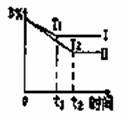
mA+nB
A.T2>T1 B.T1>T2 C.Ⅰ表示的平衡状态中B的转化率高 D.正反应是吸热反应
|
|
| 11. | 详细信息 |
|
在298 K、101kPa时,己知: 2H2O(g)=2H2(g) +O2(g) △H1 Cl2(g)+H2(g)=2HCl(g) △H2 2Cl2(g) +2H2O(g)=4HCl (g)+O2(g) △H3 则△H3与△H1和△H2间的关系正确的是 A.△H3= △H1+2△H2 B.△H3=△H1 +△H2 C.△H3= △H1- 2△H2 D.△H3=△H1-△H2
|
|
| 12. | 详细信息 |
|
下列离子方程式书写正确的是 A.NaHS水解反应:HS-+ H2O B.明矾加入水中起净化作用的原因:Al3++3H2O C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+ Ba2++2OH-= BaCO3↓+ CO32-+ 2H2O
|
|
| 13. | 详细信息 |
|
下列说法正确的是 A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 C.用0.2mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,所得溶液Ag+浓度大小关系:①>④>②>③
|
|
| 14. | 详细信息 |
|
对应可逆反应:2A(g)+B(g)
A B C D
|
|
| 15. | 详细信息 |
|
在25℃时将pH=11的NaOH溶液pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是 A.c(Na+)=c(CH3COO-)+c(CH3COOH) B.c(H+)=c(CH3COO-)+c(OH-) C.c(Na+)>c (CH3COO-)>c(OH-)>c(H+) D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
|
|
| 16. | 详细信息 | ||||||||
|
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题: (1)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知反应: N2(g)+3H2(g) 试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化: ①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol ②H2O(g)=H2O(l) ΔH =b kJ/mol 写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。 (3) 己知:HCN(aq)与NaOH(aq)反应的焓变 △H=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的焓变 △H=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变△H等于 。 (4) 己知:H2(g)+1/2O2(g)=H2O(I) △H =-285.83 kJ/mol CO(g)+1/2O2(g)=CO2(g) △H =-282.9 kJ/mol 若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(I),并放出114.3kJ热量,则混合气体中CO的物质的量为 (计算结果保留一位小数)。
|
|||||||||
| 17. | 详细信息 | ||||||||||||
|
在一定体积的密闭容器中,进行如下化学反应: CO2(g) +H2(g) 其化学平衡常数K和温度t的关系如下表:
回答下列问题: (1)该反应的化学平衡常数表达式为K= 。 (2)该反应为________反应 (填“吸热”“放热”)。 (3)能说明该反应达到化学平衡状态的是________。 A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO) (4)某温度下,平衡浓度符合下式: 3c (CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃。 (5) 830℃时,在1L密闭容器中分别投入lmolH2和lmolCO2反应达到化学平衡时,CO2的转化率 为 ;保持温度不变,在平衡体系中再充入1molH2和lmolCO2重新达到化学平衡时,CO2的平衡转化率 (填“增大”、“减小”或“不变”)•
|
|||||||||||||
| 18. | 详细信息 |
|
常温下,将0.01molNH4Cl和0.005molNaOH溶于水配成1L溶液(pH>7). (1) 该溶液中存在的三个平衡体系是____ 、 、 。 (2) 溶液中存在的离子物质的量浓度由大到小顺序为 。 (3) 这些粒子中浓度为0.01mol/L的是_______ ,浓度为0.005mol/L的是 。 (4)物质的量之和为0.0lmol的二种粒子是 。 (5) NH4+和H+两种粒子物质的量之和比OH-多 mol。
|
|
| 19. | 详细信息 |
|
(1)(6分)反应mA+nB ①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 。 ②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向 方向移动。 ③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态。 (2)(8分)乙二酸俗名草酸,易溶于水,水溶液可以用酸性KMnO4溶液进行滴定; 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 某学习小组的同学设计了如下实验方法测定草酸晶体(H2C2O4·xH2O)中x值。 主要步骤如下: A.称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。 B.取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4。 C.用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL。 ①滴定时,KMnO4标准溶液应装在 式滴定管中。 ②本实验滴定达到终点的标志是 。 ③通过上述数据,求得x= 。讨论:若滴定终点时俯视滴定管刻度, 则由此测得的x值会 。(填“偏大”、“偏小”、或“不变”)
|
|