2017高二下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
“美丽中国”是十八大提出的重大课题,它突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是: A. 用已脱硫的煤作燃料 B. 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 C. 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 D. 开发利用可燃冰是缓解能源紧缺的唯一途径
|
|
| 2. | 详细信息 |
|
下列说法中正确的是: A. 凡是放热反应都是自发的,吸热反应都是非自发的 B. 自发反应一定是熵增大,非自发反应一定是熵减小或不变 C. 自发反应在恰当条件下才能实现 D. 自发反应在任何条件下都能实现
|
|
| 3. | 详细信息 |
|
下列做法与盐类的水解无关的是: A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 B.施肥时,草木灰(有效成分为K2CO3)不能与碳铵混合使用 C.厨房中常用碳酸钠溶液洗涤餐具上的油污 D.配制FeCl2溶液时常常要在溶液中加入少量铁粉
|
|
| 4. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是: A. 对盛在烧杯(敞口)内的氨水加热,氨水中 B. 对2HI(g) C. 500 ℃左右比室温更有利于合成氨的反应 D. 高压有利于合成氨的反应
|
|
| 5. | 详细信息 |
|
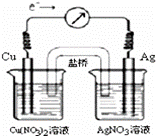
将反应Cu(s)+2Ag+(aq) A.KNO3盐桥中的K+移向Cu(NO3)2溶液 B.当电流计指针为0时,该反应达平衡,平衡常数K=0 C.工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大
|
|
| 6. | 详细信息 |
|
在进行中和热的测定中,下列操作正确的是:
B.用0.5mol/LNaOH溶液分别与0.5mol/L的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 C.使用环形玻璃搅拌棒可使反应物混合均匀,加快反应速率,减小实验误差 D.在测定中和热实验中需要使用的仪器包括:天平、量筒、烧杯、环形玻璃搅拌棒
|
|
| 7. | 详细信息 |
|
COCl2俗名光气,是有毒气体.在一定条件下,可发生的化学反应为: COCl2(g)⇌CO(g)+Cl2(g)△H<0.下列有关说法正确的是: A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 B.当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 C.单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
|
|
| 8. | 详细信息 |
|
下列溶液加热蒸干后,能析出溶质固体的是: A.Fe2(SO4)3 B.KHCO3 C.AlCl3 D.NH4HCO3
|
|
| 9. | 详细信息 |
|
下列解释实验事实的方程式中,不准确的是: A.在CH3COONa 溶液中滴入无色酚酞,溶液变红: CH3COO- + H2O B.在Mg(OH)2白色悬浊液中滴入饱和FeCl3溶液,悬浊液变红褐: 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ C.在NaHSO3溶液中滴加紫色石蕊溶液,溶液变红:NaHSO3 = Na+ + H+ + SO32- D.在草酸溶液中滴入几滴稀H2SO4酸化的KMnO4溶液,溶液无色: 2MnO4- + 5H2C2O4 + 6H + = 2Mn2+ + 10CO2↑ + 8H2O
|
|
| 10. | 详细信息 |
|
下列各溶液中,微粒的物质的量浓度关系正确的是: A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c(NH4+)>c(Cl-)> c(OH-)>c(H+) B.0.1mol·L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) C.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2∶1 D.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中, c(NH4+)的大小关系: ①>②>③
|
|
| 11. | 详细信息 |
|
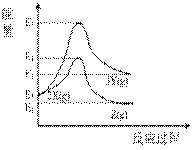
A.由X→Y 反应的ΔH = E5−E2 B.由X→Z反应的ΔH>0 C.升高温度有利于提高Z的产率 D.降低压强有利于提高Y的产率
|
|
| 12. | 详细信息 |
|
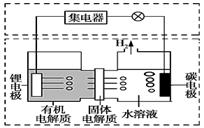
我国科学家发明的一种可控锂水电池,可作为鱼雷和潜艇的储备电源。其工作原理如图所示。下列有关说法不正确的是: A.电池工作时,电子的流向:锂电极→导线→碳电极 B.水既是氧化剂又是溶剂,有机电解质可用水溶液代替 C.电池总反应为2Li+2H2O=2LiOH+H2↑ D.该装置不仅可提供电能,还可得到清洁燃料氢气
|
|
| 13. | 详细信息 |
|
可逆反应N2(g)+3H2(g) A.①压强对反应的影响(p2>p1) B.②温度对反应的影响 C.③平衡体系增加N2对反应的影响 D.④催化剂对反应的影响[来
|
|
| 14. | 详细信息 | |||||||||||||||
|
下列实验事实与相应结论不正确的是:
|
||||||||||||||||
| 15. | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是: A.pH=1的溶液中:Fe2+、NO3-、Na+、SO42- B.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、Cl-、NO3- C.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
|
|
| 16. | 详细信息 |
|
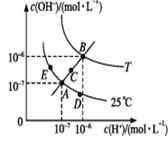
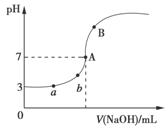
水的电离平衡曲线如图所示,下列说法不正确的是:
B.若从A点到D点,可采用:温度不变在水中加入少量的酸 C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
|
|
| 17. | 详细信息 |
|
常温下,如图是用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L HA溶液所得到的滴定曲线。下列相关的说法错误的是(忽略滴定前后体积变化) : A.由图可知HA是一种弱酸,且Ka=1.0×10-5 B.水电离出的氢离子浓度:a<b C.当NaOH溶液的体积为10.00 mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) D.B点溶液中的离子浓度关系可能为:c(Na+)>c(A-)>c(OH-)>c(H+)
|
|
| 18. | 详细信息 |
|
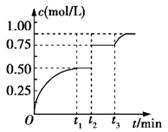
一定温度下,将1 mol A和1 mol B气体充入固定容积为2L的某密闭容器中发生反应:A(g)+B(g) A.反应方程式中的x=l B.t2时刻改变的条件是使用催化剂 C.t3时刻改变的条件是移去少量的D D.tl~t3间该反应的平衡常数均为4
|
|
| 19. | 详细信息 | ||||||||||||||
|
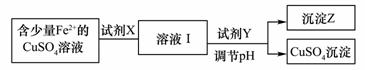
(1)刘安《淮南万毕术》中“曾青得铁则化为铜”是古代湿法炼铜的真实写照。除去CuSO4溶液中少量的Fe2+,可以按照下面的流程进行:
已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如下表:
①下列物质中适合作为试剂X的是____________ A.H2O2 B.KMnO4 C.HNO3 D.Cl2 ②加入的Y及调节的pH范围是_________________ A.Cu(OH)2 3.7~4.3 B.CuO 3.7~6.4 C. NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0 (2)已知常温下,Ksp[Cu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
|
|||||||||||||||
| 20. | 详细信息 |
|
请回答下列问题(25 ℃时): ⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中 ⑵若向0.1 mol·L-1氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式______________; ⑶若向0.1 mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH ⑷若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是____________________________。 ⑸将足量的AgCl固体分别放入:①5 mL水,②10 mL 0.2 mol·L-1 MgCl2溶液,③20 mL 0.5 mol·L-1 NaCl溶液,④40 mL 0.1 mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是____________________。 (6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol / L ,则生成沉淀所需CaCl2溶液的最小浓度为_______ mol / L。
|
|
| 21. | 详细信息 |
|
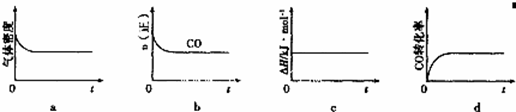
金属镍具有优良的物理和化学特性,是高技术产业的重要原料. 羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g) ①当温度升高时, ②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 (填代号)
③在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=_________mol•L﹣1•s﹣1.④要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为___(写出一条措施)
|
|
| 22. | 详细信息 |
|
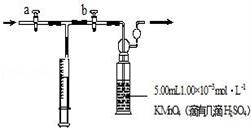
我国规定:室内甲醛含量不得超过0.08mg•m﹣3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如下图),其反应原理及步骤如下: 4MnO4﹣+5HCHO+H+═Mn2++5CO2↑+11H2O 2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
②取1.00×10﹣3mol•L﹣1草酸标准溶液于酸式滴定管中备用. ③用注射器抽取100mL新装修室内空气.再将注射器气体推入洗气瓶中充分反应。再重复③操作4次。 ④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积. ⑤再重复实验2次(每次取高锰酸钾溶液5.00mL).3次实验消耗草酸溶液的体积平均值为12.38mL. 回答下列问题 (1)5.00mL高锰酸钾用 量取. (2)此实验用指示剂 (填字母).a甲基橙 b酚酞 c淀粉 d无需另外添加试剂 (3)计算该居室内空气中甲醛的浓度 mg•m﹣3. (4)下列操作能引起室内甲醛浓度偏高的是 . a.滴定终点俯视读数 b.滴定前有气泡滴定后无气泡 c.在高锰酸钾溶液中加入少量水 d.装草酸的滴定管未润洗 (5)草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,如果向10 mL 0.01mol•L﹣1H2C2O4溶液中滴加0.01 mol•L﹣1NaOH溶液 ①当加入的NaOH溶液体积为10mL,请你写出溶液中质子守恒关系式 . ②当加入的NaOH溶液体积为20mL,请你写出溶液中离子的浓度大小关系 .
|
|