2018高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列对氢能的认识中,观点不正确的是 A.氢能只是利用氢气燃烧释放能量,是一种清洁能源 B.氢能是一种化学能 C.工业上氢气的主要来源是水煤气 D.氢能的开发中消耗的能量要大于得到的能量 |
|
| 2. | 详细信息 |
|
在25℃时,向V mL pH=a的盐酸中滴加pH=b的NaOH溶液10V mL,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)为 A.15 B.14 C.13 D.不能确定 |
|
| 3. | 详细信息 |
|
原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此又称为“铱星计划”。已知铱的一种同位素是191Ir,则该同位素的原子核内中子数与电子数的差值为 A.77 B.114 C.37 D.38 |
|
| 4. | 详细信息 |
|
某温度下,烧杯中盛X g无水盐,加入50 g水测得浓度为25%,继续加50 g水完全溶解后浓度变为20%。该温度下使X g无水盐恰好溶解,需水量为 A.75 g B.50 g C.25 g D. |
|
| 5. | 详细信息 |
|
下列各项实验基本操作中,正确的是 A.为加快过滤速度,可用玻璃棒搅拌过滤器中的液体 B.为了防止容量瓶漏水,可在玻璃塞上涂上凡士林 C.为了使制取氢气的速度加快,可向稀硫酸中加入少量硫酸铜溶液 D.为防止在配制FeCl3溶液时产生浑浊,可加入盐酸和铁钉 |
|
| 6. | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是 A.0.1 mol·L-1硝酸钙溶液中NO-3离子数目为0.2NA B.在20℃,101325Pa条件下,11.2 L氨气中含电子数为5NA C.62 g白磷中有0.5NA个白磷分子 D.同温同压下,任何气体单质都含有相同原子数目 |
|
| 7. | 详细信息 |
|
A元素的原子最外层的电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成化合物的化学式可能表示为 A.B3A2 B.BA2 C.A3B2 D.AB2 |
|
| 8. | 详细信息 |
|
下列实验方案不合理或叙述错误的是 ①加热乙酸和乙醇的混合液制备乙酸乙酯 ②向含有少量甲苯的苯中滴加酸性高锰酸钾溶液,然后分液除去甲苯 ③向乙醛和1-己烯中分别加入溴水,通过观察颜色变化区别二者 ④让乙烷和乙烯的混合气体通过酸性高锰酸钾浓溶液以净化乙烷 ⑤用启普发生器制备乙炔 A.全部 B.①③⑤ C.①③ D.②③④ |
|
| 9. | 详细信息 |
|
美国等国家发射的航天器将我国研制的磁谱仪带入太空,其目的是探索反物质。反物质的主要特征是电子带正电荷,质子带负电荷。以下表示反物质酸碱中和反应的通式是 A.H-+OH+===H2O B.H++OH-===H2O C.H-+OH-===H2O D.H+OH===H2O |
|
| 10. | 详细信息 |
|
下列做法中不正确的是 A.水银温度计不慎摔破后,在散落的汞滴上覆盖硫粉 B.苯酚溶液不慎沾到皮肤上,立即用酒精洗涤 C.浓硫酸不慎沾在皮肤上,尽快用水冲洗 D.给装在试管中的液体加热时,试管口不能对着自己或他人 |
|
| 11. | 详细信息 |
|
在能跟铝作用放出氢气的溶液中,一定不能大量共存的离子组是 A.Al3+,NH C.Rb+,Na+,Cl-,NO |
|
| 12. | 详细信息 |
|
下列离子方程式书写正确的是 A.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O B.次氯酸钙溶液中通入过量的CO2 Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO C.向100 mL 0.1 mol·L-1的FeBr2溶液中通入0.015 mol的Cl2 2Fe2++4Br-+3C12===2Fe3++2Br2+6Cl- D.向明矾溶液逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全 A13++SO |
|
| 13. | 详细信息 |
|
某有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂肉为多。该化合物具有如下性质:①1 mol X与足量的金属钠反应产生1.5 mol气体 ②X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物 ③X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应。根据上述信息,对X的结构判断正确的是 A.X中肯定有碳碳双键 B.X中可能有三个羟基和一个—COOR官能团 C.X中可能有三个羧基 D.X中可能有两个羧基和一个羟基 |
|
| 14. | 详细信息 |
|
氢化钠跟水反应生成氢氧化钠和氢气。现有氢化钠和铝粉混合物a g,与足量水充分反应后,若收集到b g氢气。则混合物中铝的质量可能是 A.大于(a-12b) g B.小于(a-12b) g C.等于(a-12b) g D.无法判断 |
|
| 15. | 详细信息 |
|
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时先向A中加入铁屑,B中加入较浓的NaOH溶液,打开活塞E,再从分液漏斗中加入少量6 mo1·L-1 H2SO4溶液,等一段时间后,继续加硫酸浸没F导管的下端:
(1)A中反应的离子方程式为 。 (2)实验开始时加入少量6 mo1· L-1硫酸并等待一段时间的目的是 、 。 (3)关闭E,在A装置中可观察到的现象是 。在B装置中观察到的现象是 。 (4)C装置的作用是 。 (5)拔去装置B中的橡皮塞使空气进入,写出有关的化学方程式 。 |
|
| 16. | 详细信息 |
|
某学生准备用37%、密度为1.19 g/mL的浓盐酸配制0.1 mo1·L-1的稀盐酸500 mL。请回答下列问题: (1)量取浓盐酸的体积为 mL,应选用量筒的规格为 mL。 (2)配制时应选用容量瓶的规格为 mL。 (3)配制时(除容量瓶外)还需选用的仪器主要有烧杯、 、 和试剂瓶。 |
|
| 17. | 详细信息 |
|
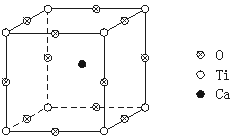
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有 、 个。 (2)该晶体结构中,元素氧、钛、钙的离子个数比是 。该物质的化学式可表示为 。 (3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-9 m),则该晶体的密度为 g·cm-3。 |
|
| 18. | 详细信息 |
|
碳正离子〔例如CH (1)CH (2)CH (3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是 。 (4)(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是 。 |
|
| 19. | 详细信息 |
|
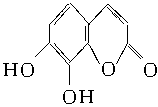
瑞香素是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。
(1)瑞香素的化学式为 ,属于 类型有机物。 (2)1 mol此化合物可与 mol Br2反应,在一定条件下与H2反应时,最多消耗H2的物质的量为 mol。 (3)写出此化合物与强碱NaOH溶液反应的化学方程式 。 |
|
| 20. | 详细信息 |
|
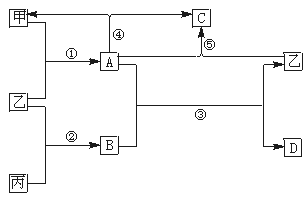
如图所示,甲、乙、丙是三种常见单质,乙是金属,A、B、C、D分别是由甲、乙、丙中各两种元素组成的化合物,①~⑤五个反应都需要在一定温度下才能进行。其中,A、B是黑色固体,C是红色固体,D是气体,据此回答:
A、B、C、D四种化合物中必含甲、乙两种元素的是 ;单质甲、乙、丙分别是 、 、 ;下列两反应都需要高温下进行,写出反应的化学方程式: A+B→乙+D: , A+乙→C: 。 |
|
| 21. | 详细信息 |
|
为测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol·L-1的硫酸中,再加入400 mL 8 mol·L-1的NaOH溶液充分反应,得到白色沉淀。 (1)若只有一种沉淀,试确定合金中镁的质量分数范围。 (2)若沉淀质量为26.3 g,则镁的质量分数为多少? |
|
| 22. | 详细信息 |
|
在一定温度下,将100 mL N2和H2的混合气体充入密闭的恒压容器中进行反应,达到平衡时,测得混合气体的密度是反应前密度的1.25倍,平均摩尔质量为15.5 g· mol-1。求达到平衡时N2的转化率。 |
|