2019山西高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列说法中正确的是( ) A. 电子云通常是用小黑点来表示电子的多少 B. 处于最低能量的原子叫基态原子 C. 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 D. 电子仅在激发态跃迁到基态时才会产生原子光谱
|
|
| 2. | 详细信息 |
|
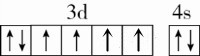
下列说法或有关化学用语的表达正确的是( ) A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 B. 基态Fe原子的外围电子排布图为 C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 D. 根据原子核外电子排布的特点,Cu在周期表中属于s区元素
|
|
| 3. | 详细信息 |
|
玻尔理论、量子力学理论都是对核外电子运动的描述方法,根据对它们的理解,下列叙述中正确的是( ) A. 因为轨道的形状是球形的,所以电子做的是圆周运动 B. 3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 C. 处于同一轨道上的电子可以有多个,它的运动状态完全相同 D. 原子轨道和电子云都是用来形象地描述电子运动状态的
|
|
| 4. | 详细信息 |
|
周期表共有18个纵行,从左到右排为1~18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是( ) A. 第9列元素中没有非金属元素 B. 只有第2列的元素原子最外层电子排布为ns2 C. 第四周期第9列元素是铁元素 D. 第10、11列为ds区
|
|
| 5. | 详细信息 |
|
下列关于元素第一电离能的说法不正确的是( ) A. 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B. 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C. 最外层电子排布式为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 D. 对于同一元素而言,原子的电离能I1<I2<I3
|
|
| 6. | 详细信息 |
|
下列各组原子中,彼此化学性质一定相似的是( ) A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 C. 2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子 D. 最外层都只有一个电子的X、Y原子
|
|
| 7. | 详细信息 |
|
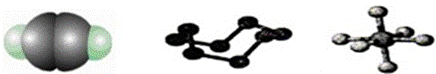
下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
A. 32 g S8分子中含有0.125 mol σ键 B. SF6是由极性键构成的分子 C. 1 mol C2H2分子中有3 mol σ键和2 mol π键 D. S8中S的杂化方式为sp3杂化
|
|
| 8. | 详细信息 |
|
下列表达方式或说法正确的是( ) A. CO2的分子模型示意图: B. 某元素原子R的轨道表示式: C. pp π键电子云模型: D. 乙烯分子的球棍模型:
|
|
| 9. | 详细信息 |
|
化合物NH3与BF3可以通过配位键形成NH3·BF3,下列说法正确的是( ) A. NH3与BF3都是三角锥形 B. NH3与BF3中心原子杂化方式相同 C. NH3·BF3中各原子都达到8电子稳定结构 D. NH3·BF3中,NH3提供孤电子对,BF3提供空轨道
|
|
| 10. | 详细信息 |
|
下列说法错误的是( ) A. 1 mol HCl分子和1 mol HF分子断键需要的能量前者小于后者 B. I3+离子的几何构型为 v形,中心原子的杂化形式为 sp2 C. 在NH4+和[Cu(NH3)4]2+中都存在配位键 D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
|
|
| 11. | 详细信息 |
|
美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( ) A. NO2﹣和NH4+ B. H3O+和ClO3﹣ C. NO3﹣和CO32﹣ D. PO43﹣和SO42
|
|
| 12. | 详细信息 |
|
下列物质组成元素间电负性差值可能大于1.8的化合物是( ) A. CH4 B. CO C. NO2 D. Na2O
|
|
| 13. | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。下列说法正确的是( ) A. W、Y、Z的电负性大小顺序一定是Z>Y>W B. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z C. Y、Z形成的分子的空间构型可能是正四面体 D. WY2分子中σ键与π键的数目之比是2∶1
|
|
| 14. | 详细信息 |
|
以下有关元素性质的说法不正确的是( ) A. 具有下列电子排布式的原子中:①1s22s22p63s23p2、②1s22s22p3、③1s22s22p2、④1s22s22p63s23p4,原子半径最大的是① B. 具有下列最外层电子排布式的原子中:①3s23p1、②3s23p2、③3s23p3、④3s23p4,第一电离能最大的是③ C. ①Na、K、Rb、②N、P、As、③O、S、Se、④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ D. 某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+
|
|
| 15. | 详细信息 |
|
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( ) A. 配合物中中心原子的电荷数和配位数均为6 B. 该配合物可能是平面正方形构型 C. Cl-和NH3分子均与Pt4+配位 D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
|
|
| 16. | 详细信息 |
|
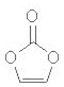
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是
A. 分子式为C3H2O3 B. 分子中含6个σ键 C. 分子中只有极性键 D. 8.6g该物质完全燃烧得到6.72LCO2
|
|
| 17. | 详细信息 |
|
据报道,大气中存在一种潜在的温室气体SF5—CF3,下列关于SF5—CF3的说法正确的是( ) A. 分子中既有σ键又有π键 B. 所有原子在同一平面内 C. C的杂化方式为sp3杂化 D. 0.1 mol SF5—CF3分子中含8 mol电子
|
|
| 18. | 详细信息 |
|
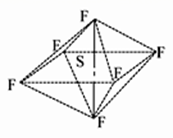
SF6是一种无色气体,具有很强的稳定性,可用于灭火,SF6的分子结构如图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为 ( )
A. 6种 B. 7种 C. 10种 D. 12种
|
|
| 19. | 详细信息 | |||||||
|
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式:________。 (2)B元素基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。 (3)某同学根据上述信息,推断C基态原子的核外电子排布图为
(4)G位于第_____族_____区,该元素的核外电子排布式为_____________________________。 (5)检验F元素的方法是____________。
|
||||||||
| 20. | 详细信息 |
|
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的价电子排布式为_________,3d能级上的未成对的电子数为______。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4中配体的构型是____________阴离子的立体构型是______________。 (3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是_______________。
|
|
| 21. | 详细信息 |
|
将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。 (1)溶液中呈天蓝色微粒的化学式是______,1 mol该天蓝色微粒所含的σ键数目为______。 (2)加入乙醇的作用是_____________________。 (3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。 (4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,该晶体中配离子的空间构型为_________。(用文字描述)
|
|
| 22. | 详细信息 |
|
铍及其化合物的应用正日益被重视。在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答: (1)锂在空气中燃烧,除生成Li2O外,也生成微量的_________(填化学式)。 (2)铍的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________________________________________。 (3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),a属于________(填“离子”或“共价”)化合物,写出它的一个等电子体_________。 (4)二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________(标出配位键)。
|
|
| 23. | 详细信息 |
|
氮及其化合物与人类生产、生活息息相关。回答下列问题: (1)基态氮原子中电子在2p轨道上的排布遵循的原则是______________。 (2)C、N、O三种元素第一电离能从大到小的顺序是_____________________。 (3)NF3的键角____________NH3的键角(填“<”“>”或“=”)。 (4)N2F2分子中氮原子的杂化方式是____________,1 mol N2F2含有____________molσ键。 (5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。
|
|