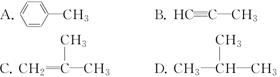2018高二上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
室温下,下列事实不能说明NH3•H2O为弱电解质的是 A.0.1 mol•L﹣1 NH3•H2O溶液的pH小于13 B.0.1 mol•L﹣1 NH4Cl溶液的pH小于7 C.相同条件下,浓度均为0.1 mol•L﹣1 NaOH溶液和氨水,氨水的导电能力弱 D.0.1 mol•L﹣1 NH3•H2O能使无色酚酞试液变红色
|
|
| 2. | 详细信息 |
|
下列电离方程式书写正确的是 A.NaHCO3 ═ Na++H++CO32- B.NaHSO4 ═ Na++H++SO42- C.Al2(SO4)3 ═ Al3++SO42- D.NH3•H2O ═ NH4++OH-
|
|
| 3. | 详细信息 |
|
下列原子或原子团不属于官能团的是 A.—CH3 B.—F C.—OH D.
|
|
| 4. | 详细信息 |
|
某学生的实验报告所列出的下列数据中合理的是 A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaCl C.用广泛pH试纸测得某溶液的pH为2.3 D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
|
|
| 5. | 详细信息 |
|
相同温度下,有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是 A.两溶液物质的量浓度相同 B.两溶液中OH-浓度相同 C.用同浓度的盐酸中和时,消耗盐酸的体积相同 D.加入等体积的水稀释后,pH仍相等
|
|
| 6. | 详细信息 |
|
下列说法中错误的是 ①根据红外光谱图的分析可以初步判断有机物中具有哪些基团 ②分子组成相差一个或几个CH2原子团的有机物是同系物 ③同系物一定同类,且电子数之差一定为8的整数倍 ④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似 A.只有①②③ B.①②③④ C.只有①③④ D.②④
|
|
| 7. | 详细信息 |
|
碱性电池具有容量大、放电电流大的特点,得到广泛应用。锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+MnO2(s)+H2O(l)═ZnO(s)+Mn(OH) 2 (s),下列说法错误的是 A.电池工作时,锌失去电子 B.电池工作时,电子由负极经过电解质溶液流向正极 C.电池正极的电极反应式为:MnO2(s) +2H2O(l)+2e-═Mn(OH)2 (s)+2OH-(aq) D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
|
|
| 8. | 详细信息 |
|
下列说法不正确的是 A.常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B.浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32-) C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
|
|
| 9. | 详细信息 |
|
下列烃的系统命名正确的是 A.2﹣乙基丁烷 B.2﹣乙基﹣2﹣丁烯 C.2﹣甲基﹣1﹣丁炔 D.1,2﹣二甲苯
|
|
| 10. | 详细信息 |
|
下列用来表示物质变化的化学用语中,正确的是 A.氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为: PbSO4(s)﹣2e-+2H2O(l)═PbO2(s)+4H+(aq)+SO42-(aq) C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu﹣2e-═Cu2+ D.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e-═Fe2+
|
|
| 11. | 详细信息 |
|
下列分子式只能表示一种物质的是 A.C3H7Cl B.CH2Cl2 C.C2H6O D.C2H4O2
|
|
| 12. | 详细信息 |
|
下列有关说法正确的是 A.将AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 C.将纯水加热至较高温度,KW变大、pH变小、呈酸性 D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
|
|
| 13. | 详细信息 |
|
下列五种烃①2-甲基丁烷 ②2,2-二甲基丙烷 ③正戊烷 ④丙烷 ⑤丁烷,按沸点由高到低的顺序排列的是 A.①>②>③>④>⑤ B.②>③>⑤>④>① C.③>①>②>⑤>④ D.④>⑤>②>①>③
|
|
| 14. | 详细信息 |
|
下列有关说法正确的是 A.一定条件下反应N2+3H2 B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 C.将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 D.25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
|
|
| 15. | 详细信息 |
|
下列有机化合物分子中的所有碳原子不可能处于同一平面的是
|
|
| 16. | 详细信息 |
|
标准状况下,两种气态烃的混合物共2.24L,完全燃烧后得3.36L二氧化碳和3.6g的水。下列说法中正确的是 A.混合气体中一定含有甲烷 B.混合气体中一定含有乙烯 C.混合气体中可能含有乙炔 D.混合气体一定是由烷烃和烯烃构成
|
|
| 17. | 详细信息 |
|
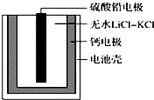
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca═ CaCl2+Li2SO4+Pb。下列有关说法正确的是
B.放电过程中,Li+向负极移动 C.常温时,在正负极间接上电流表或检流计,指针发生偏转 D.每转移0.1 mol电子,理论上生成10.35g Pb
|
|
| 18. | 详细信息 |
|
14.5g某烷烃完全燃烧生成1.25mol H2O,则该烃的一氯代物共有(不考虑立体异构) A.2种 B.3种 C.4种 D.5种
|
|
| 19. | 详细信息 |
|
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为:2Cu+H2O
B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
|
|
| 20. | 详细信息 | |||
|
某有机物分子中含有n个﹣CH2﹣,m个 ,a个﹣CH3,其余为﹣Cl,则Cl的个数为 A.2n+3m﹣a B.m+2﹣a C.n+m+a D.m+2n+2﹣a
|
||||
| 21. | 详细信息 | |||||||||||||||
|
下列实验事实得出的相应结论不正确的是
|
||||||||||||||||
| 22. | 详细信息 |
|
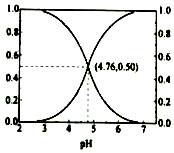
25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是
A.在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH) B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 C.在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变
|
|
| 23. | 详细信息 | ||||||||||||||||||||||
|
描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1 表2
请回答下列问题: (1)表1所给的四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是 (填字母序号)。 A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 (2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为 。 (3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为 。 (4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L﹣1,则溶液中CO32-物质的量浓度最少应为 。
|
|||||||||||||||||||||||
| 24. | 详细信息 |
|
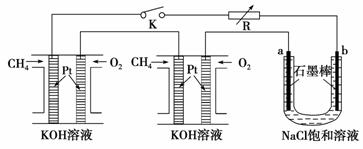
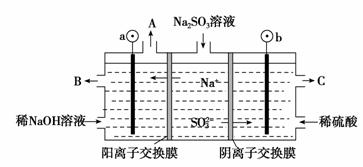
(I)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题: (1)甲烷燃料电池负极的电极反应式为 。 (2)闭合开关K后,a、b电极上均有气体产生,其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 。 (II)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
(1)图中a极要连接电源的(填“正”或“负”) 极,C口流出的物质是 。 (2)b电极SO (3)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
|
|
| 25. | 详细信息 |
|
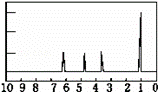
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验: (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:A的相对分子质量为 。 (2)将9.0g A在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为 。 (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)。 实验结论:A中含有的官能团(名称): 。 (4)A的核磁共振氢谱如图。实验结论:A中含有 种氢原子。
(5)综上所述,A的结构简式为 。
|
|
| 26. | 详细信息 | ||||||||||
|
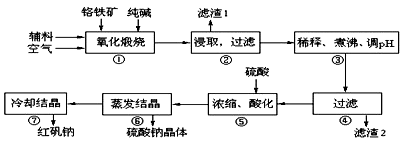
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有: 主反应:4FeO•Cr2O3+8Na2CO3+7O2 副反应:SiO2+Na2CO3 部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
试回答下列问题: (1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。 (2)③中调节pH至4.7,目的是 。 (3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。 (4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L﹣1H2SO4和足量NaI(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L﹣1Na2S2O3标准溶液滴定。 (已知:I2+2S2O32-=2I-+S4O62-) ① 判断达到滴定终点的依据是: ; ② 若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度为(设整个过程中其它杂质不参与反应) 。
|
|||||||||||