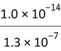2019高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
解释下列物质性质的变化规律与物质结构间的因果关系时与键能无关的变化规律是( ) ①HF、HCl、HBr、HI的热稳定性依次减弱 ②NH3易液化 ③F2、Cl2、Br2、I2的熔、沸点逐渐升高 ④H2S的熔、沸点小于H2O的熔、沸点 ⑤NaF、NaCl、NaBr、NaI的熔点依次减低 A. ①③④ B. ③④ C. ②③④ D. 全部
|
|
| 2. | 详细信息 |
|
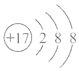
下列化学用语的表达正确的是 ( ) A. 原子核内有10个中子的氧原子 B. 氯原子的结构示意图: C. Fe3+的最外层电子排布式为3s23p63d5 D. 基态铜原子的外围电子排布图:
|
|
| 3. | 详细信息 |
|
化学与生产、生活、环境等息息相关,下列有关说法中不正确的是( ) A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 B. 绿色化学要求从源头上消除或减少生产活动对环境的污染 C. 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 D. 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料
|
|
| 4. | 详细信息 |
|
某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) ⇋4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( ) ①该反应的化学平衡常数表达式为: ②此时B的转化率为35% ③增大该体系压强,平衡向右移动,但化学平衡常数不变 ④增加C的量,A、B转化率不变 A. ①② B. ②③ C. ③④ D. ①④
|
|
| 5. | 详细信息 |
|
实验:①向盛有1 mL 0.1 mol·L-1MgCl2溶液试管中加1 mL 0.2 mol·L-1NaOH溶液,得到浊液a,过滤得到滤液b 和白色沉淀c。②向沉淀c中滴加0.1mol·L-1FeCl3溶液,沉淀变为红褐色。下列分析不正确的是( ) A. 滤液b中不含有Mg2+ B. 实验可以证明Fe(OH)3比Mg(OH)2更难溶 C. ②中颜色变化说明Mg(OH)2转化为Fe(OH)3 D. 浊液a中存在沉淀溶解平衡:Mg(OH)2(s) ⇋Mg2+ (aq)+2OH-(aq)
|
|
| 6. | 详细信息 |
|
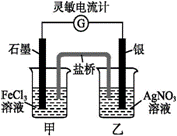
控制适合的条件,将反应Fe3++Ag⇋Fe2++Ag+设计成如下图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后,观察到电流计指针向右偏转。下列判断不正确的是( )。
A. 在外电路中,电子从银电极流向石墨电极 B. 盐桥中的K+移向甲烧杯 C. 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 D. 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
|
|
| 7. | 详细信息 |
|
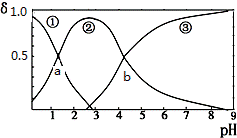
草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4-、C2O42-的浓度分数δ随溶液pH变化的关系如下图,以下说法正确的是( )
A. HC2O4-的浓度分数随pH增大而增大 B. 交点a处对应加入的NaOH溶液的体积为5mL C. 交点b处c(H+)=6.4×10-5 D. pH=5时存在c(Na+)+c(H+)=c(C2O42-)+c(HC2O4-)+c(OH-)
|
|
| 8. | 详细信息 |
|
下列关于金属晶体的叙述正确的是( ) A. 用铂金做首饰不能用金属键理论解释 B. 固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体 C. Li、Na、K的熔点逐渐升高 D. 金属导电和熔融电解质(或电解质溶液)导电的原理一样。
|
|
| 9. | 详细信息 |
|
下列分子属于手性分子的是( ) A. CCl2F2 B.
|
|
| 10. | 详细信息 |
|
CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:NH3+CO2→ A. C、N、O原子采用相同的杂化方式 B. 分子中所有原子一定共平面 C. 分子式为C3H3N3O3 D. 生成该物质的上述反应为中和反应
|
|
| 11. | 详细信息 |
|
下列物质的熔、沸点高低顺序中,正确的是( ) A. 金刚石>晶体硅>二氧化硅>碳化硅 B. Rb>K>Na C. F2>Cl2>Br2>I2 D. CI4>CBr4>CCl4>CF4
|
|
| 12. | 详细信息 |
|
某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法错误的是( )
A. 充电时,太阳能转化为电能,电能又转化为化学能 B. 放电时,a极为负极 C. 充电时,阳极的电极反应式为3I--2e-= I3- D. M是阴离子交换膜
|
|
| 13. | 详细信息 |
|
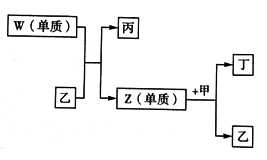
X、Y、Z、W 是短周期中原子序数依次增大的四种元素。X可以分别与Y、Z、W 结合生成甲、乙、丙三种相同质子数的分子;相关物质之间的转化关系如图所示,已知丁是无色气体,遇空气显红棕色。下列说法正确的是
A. 原子半径的大小:W>X>Y>Z B. 单质的稳定性:X>Y>Z>W C. 简单氢化物的沸点:Y>Z>W D. X 与Y、Z 均可形成原子个数比为2: 1的化合物
|
|
| 14. | 详细信息 |
|
元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为( )nm A. 404.4 B. 553.5 C. 589.2 D. 670.8
|
|
| 15. | 详细信息 | ||||||||||||||||||||
|
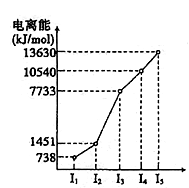
已知X、Y、Z为同一周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
下列说法正确的是( ) A. 三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也最小 B. 三种元素中,Y元素的第一电离能最大,其电负性也最大 C. 等物质的量的X、Y、Z三种单质与少量盐酸反应放出氢气的物质的量之比为1:1:1 D. 三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比为3:2:1
|
|||||||||||||||||||||
| 16. | 详细信息 |
|
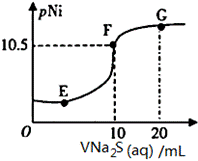
已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:Ka1=1.3×10-7,Ka2=7.1×10-15。常温下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法不正确的是( )。
A. E、F、G三点中,F点对应溶液中水电离程度最小 B. 常温下,Ksp(NiS)=1×10-21 C. 在NiS和NiCO3的浊液中 D. Na2S溶液中,S2-第一步水解常数Kh1=
|
|
| 17. | 详细信息 |
|
在下列物质中: ①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar (1)只存在极性键的分子是____;只由非极性键构成的非极性分子是____;(填序号,下同)。 (2)既存在极性键又存在非极性键的分子是________。 (3)只存在σ键的分子是________,既存在σ键又存在π键的分子是________。 (4)不存在化学键的是_________。 (5)既存在离子键又存在极性键的是________。
|
|
| 18. | 详细信息 | ||||||||||||
|
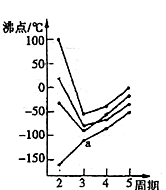
(1)第四周期的某主族元素,其第一至第五电离能数据如下图所示,则该元素对应原子的M层电子排布式为________。
(2)如下图所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________。
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。 a.离子键 b.配位键 c.氢键 d.非极性共价键 若化合物(CH3)3N能溶于水,试解析其原因__________。 (4)CO2在高温高压下所形成的晶体其晶胞如下图所示。该晶体的熔点比SiO2晶体____(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________。
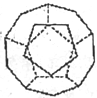
(5)如下图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;则:C20分子共有____个正五边形,共有______条棱边。 (6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为___(填“有”或“无”)色离子,依据是_______。
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______。
|
|||||||||||||
| 19. | 详细信息 |
|
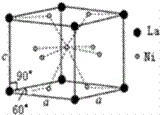
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。 (1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。 ①Cu的基态原子价电子排布式为_____________, ②Ni的基态原子共___________有种不同能级的电子。 (2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑ ①上述化学方程式中非金属元素电负性由大到小的顺序是,______,(用元素符号表示) ②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为______;中心原子的杂化方式为______。 ③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.910-2nm和7.810-2nm。则熔点NiO____FeO (填“>”、“<”或“=”),原因是_______。 (3)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示:
①该晶体的化学式为__________; ②已知该晶体的摩尔质量为Mg /mol,密度为dg/cm3,设NA为阿伏加德罗常数的值。则该晶胞的体积是__________cm3 (用M、d、NA的代数式表示) ③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3。储氢能力=
|
|
| 20. | 详细信息 |
|
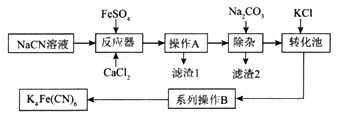
亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
请回答下列问题: (1)常温下,HCN的电离常数Ka=6.2×10-10。 ①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。 ②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。 (2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。 (3)系列操作B为_____________________。 (4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。 (5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
①K+移向催化剂___________(填“a”或“b”)。 ②催化剂a表面发生的反应为_________________。
|
|
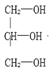 C. CH3CH2OH D.
C. CH3CH2OH D. 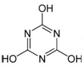 +H2O。下列有关三聚氰酸的说法正确的是( )
+H2O。下列有关三聚氰酸的说法正确的是( )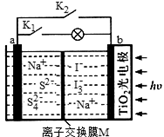
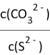 =1.4×1014
=1.4×1014