2018й»‘йҫҷжұҹй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰеңЁз”ҹдә§е’Ңз”ҹжҙ»дёӯжңүйҮҚиҰҒзҡ„еә”з”ЁпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) В В AпјҺе°ҸиӢҸжү“еңЁз”ҹжҙ»дёӯеҸҜз”ЁеҒҡеҸ‘й…өзІүВ В В В В В В В В В В BпјҺиҝҮж°§еҢ–й’ еҸҜз”ЁдәҺе‘јеҗёйқўе…·дёӯж°§ж°”зҡ„жқҘжәҗ В В CпјҺеҸҜжә¶жҖ§й“ҒзӣҗжҲ–й“қзӣҗеҸҜз”ЁдәҺеҮҖж°ҙВ В В В В В В В В В В DпјҺзўій…ёй’ еёёз”ЁдәҺжІ»з–—иғғз—…
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е®һйӘҢж“ҚдҪңжҲ–еҜ№е®һйӘҢдәӢе®һзҡ„еҸҷиҝ°пјҢжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺз”Ёж°Ёж°”еҒҡе–·жіүе®һйӘҢдё»иҰҒжҳҜеҲ©з”Ёж°Ёж°”зҡ„ж°ҙжә¶ж¶Іе‘ҲзўұжҖ§иҝҷдёҖжҖ§иҙЁ BпјҺеёёжё©дёӢпјҢжө“H2SO4еҸҜиҙ®еӯҳдәҺй“ҒеҲ¶жҲ–й“қеҲ¶е®№еҷЁдёӯ CпјҺз”Ёз“·еқ©й”…й«ҳжё©зҶ”иһҚNaOH DпјҺеҗ‘жә¶ж¶ІдёӯеҠ е…Ҙзӣҗй…ёй…ёеҢ–зҡ„BaCl2жә¶ж¶ІпјҢд»ҘзЎ®е®ҡе…¶дёӯжҳҜеҗҰеҗ«жңүSO42-
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ | ||||
|
з»Ҹж°Ҝж°”ж¶ҲжҜ’зҡ„иҮӘжқҘж°ҙпјҢиӢҘз”ЁдәҺй…ҚеҲ¶д»ҘдёӢжә¶ж¶Іпјҡв‘ Na2SO3В В в‘ЎKIВ В В в‘ўAlCl3В В в‘ЈFeCl2в‘ӨAgNO3В в‘ҘNaOHВ дјҡдҪҝй…ҚеҲ¶зҡ„жә¶ж¶ІеҸҳиҙЁзҡ„жҳҜпјҲгҖҖгҖҖпјү
|
|||||
| 4. | иҜҰз»ҶдҝЎжҒҜ | ||||
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
|
|||||
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁй…ёжҖ§жә¶ж¶ІдёӯпјҢиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ(гҖҖгҖҖ) AпјҺMg2пјӢгҖҒFe2пјӢгҖҒNO CпјҺKпјӢгҖҒNaпјӢгҖҒNO
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дә”з§ҚжңүиүІжә¶ж¶ІдёҺSO2дҪңз”ЁпјҢеқҮиғҪиӨӘиүІпјҢе…¶е®һиҙЁзӣёеҗҢзҡ„жҳҜпјҡв‘ е“Ғзәўжә¶ж¶ІВ В в‘Ўж°Ҝж°ҙВ в‘ўж»ҙжңүй…ҡй…һзҡ„NaOHжә¶ж¶ІВ В в‘ЈВ ж»ҙжңүж·ҖзІүзҡ„зўҳжә¶ж¶ІВ В В в‘Өй…ёжҖ§KMnO4жә¶ж¶ІВ (гҖҖгҖҖ) AпјҺв‘ в‘ЈВ В В В BпјҺв‘ в‘Ўв‘ўВ В В В CпјҺв‘Ўв‘ўв‘ЈВ В В В DпјҺв‘Ўв‘Јв‘Ө
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еҠ зғӯNH4HCO3еӣәдҪ“пјҢдҪҝдә§з”ҹзҡ„ж°”дҪ“дҫқж¬ЎйҖҡиҝҮзӣӣжңүиҝҮйҮҸNa2O2зҡ„е№ІзҮҘз®ЎгҖҒжө“H2SO4зҡ„жҙ—气瓶пјҢжңҖеҗҺеҫ—еҲ°зҡ„ж°”дҪ“жҳҜоҖғ(гҖҖгҖҖ)оҖғ В A. NH3В В В В В В В В В В В В В В В В В В В B. O2В В В В В В В В В В В В В В В В оҖғC. H2OВ В В В В В В В В В В В В В В В В В В D.CO2оҖғ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁд№Ӣй—ҙ зҡ„иҪ¬еҢ–дёҚиғҪйҖҡиҝҮдёҖжӯҘеҢ–еҗҲеҸҚеә”е®һзҺ°зҡ„жҳҜ(гҖҖгҖҖ) AпјҺ Al2O3В вҶ’ AlпјҲOHпјү3 В В В В В В В В В В В В В В В В В В BпјҺ FeCl3вҶ’FeCl2 C . FeпјҲOHпјү2вҶ’FeпјҲOHпјү3В В В В В В В В В В В В В В В В DпјҺ Na2CO3вҶ’NaHCO3
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дҪҝ0.15molMnO2дёҺиҝҮйҮҸзҡ„12molВ·L-1зҡ„жө“зӣҗй…ёеҸҚеә”пјҢдҪҝ50mL12molВ·L-1зҡ„жө“зӣҗй…ёдёҺи¶ійҮҸMnO2еҸҚеә”пјҢдёӨиҖ…дә§з”ҹзҡ„ж°Ҝж°”зӣёжҜ”пјҲе…¶д»–жқЎд»¶зӣёеҗҢпјү(гҖҖгҖҖ)гҖӮ AпјҺдёҖж ·еӨҡВ В В В В В BпјҺВ еҗҺиҖ…иҫғеүҚиҖ…еӨҡВ В В В CпјҺеүҚиҖ…иҫғеҗҺиҖ…еӨҡВ В В В В DпјҺж— жі•жҜ”иҫғ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„жә¶ж¶ІеңЁеҸӘжҸҗдҫӣиғ¶еӨҙж»ҙз®Ўе’ҢиҜ•з®ЎпјҢдёҚе…¶д»–иҜ•еүӮе°ұеҸҜд»ҘеҢәеҲ«зҡ„жҳҜ (гҖҖгҖҖ) в‘ CaCl2е’ҢNa2CO3жә¶ж¶ІВ в‘ЎNaOHжә¶ж¶Іе’ҢAlCl3жә¶ж¶ІВ в‘ўNaHCO3жә¶ж¶Іе’Ңзӣҗй…ёВ в‘ЈзЁҖзЎ«й…ёе’ҢNa2CO3жә¶ж¶І в‘ӨNaHCO3жә¶ж¶Іе’ҢBaпјҲOHпјү2жә¶ж¶ІВ в‘ҘNaAlO2жә¶ж¶Іе’ҢNaHSO4жә¶ж¶ІВ В в‘ҰCuSO4жә¶ж¶Іе’ҢNaOHжә¶ж¶І В AпјҺв‘Ўв‘Јв‘Ҙв‘ҰВ В В В BпјҺв‘ в‘ўв‘Јв‘ҘВ В В CпјҺв‘Ўв‘ўв‘Јв‘Өв‘ҘВ В DпјҺв‘Ўв‘Өв‘Ҙв‘Ұ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜВ В В (В В В ) В В В AпјҺж°ҜеҢ–й“қжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡAl3++4NH3В·H2O = AlO2-+4NH4++2H2O BпјҺNaдёҺH2OеҸҚеә”пјҡNa+2H2O==Na++2OH-+ H2вҶ‘ CпјҺиҝҮйҮҸж°ўж°§еҢ–й’ҷдёҺзўій…ёж°ўй’ жә¶ж¶ІеҸҚеә”Ca2+ +2 HCO3пјҚпјӢ2OH-= CaCO3вҶ“+ 2H2O+CO32- DпјҺзўій…ёж°ўй’ҷе’Ңзӣҗй…ёеҸҚеә”HCO3пјҚпјӢHпјӢ= CO2вҶ‘пјӢH2O
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
пјҺдёӢеҲ—еҗ„з»„зү©иҙЁдёӯпјҢXжҳҜдё»дҪ“зү©иҙЁпјҢYжҳҜе°‘йҮҸжқӮиҙЁпјҢZжҳҜдёәйҷӨеҺ»жқӮиҙЁжүҖиҰҒеҠ е…Ҙзҡ„иҜ•еүӮпјҢе…¶дёӯжүҖеҠ иҜ•еүӮжӯЈзЎ®зҡ„дёҖз»„жҳҜ(гҖҖгҖҖ)
|
|||||||||||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іе®һйӘҢж“ҚдҪңиҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) В в‘ еҒҡй’ҫзҡ„з„°иүІеҸҚеә”йңҖиҰҒз”Ёй“ӮдёқгҖҒж°ҜеҢ–й’ҫжә¶ж¶ІгҖҒи“қиүІй’ҙзҺ»з’ғгҖҒзЎ«й…ёжә¶ж¶І В в‘ЎиҝҮж°§еҢ–й’ е’Ңж°ҙеҸҚеә”еҗҺзҡ„жә¶ж¶Ідёӯж»ҙеҠ й…ҡй…һиҜ•ж¶ІеҗҺжә¶ж¶ІеҸҳзәўпјҢжҢҜиҚЎеҗҺеҸҲиӨӘиүІ В в‘ўйӘҢиҜҒе°ҸиӢҸжү“дёӯжҳҜеҗҰеҗ«жңүзәҜзўұ,еҸ–ж ·жә¶дәҺж°ҙдёӯпјҢж»ҙеҠ е°‘йҮҸж°ўж°§еҢ–й’Ўжә¶ж¶ІпјҢи§ӮеҜҹжңүж— зҷҪиүІжІүж·Җдә§з”ҹ В в‘ЈеҲҶж¶Іж“ҚдҪңж—¶пјҢеҲҶж¶ІжјҸж–—дёӯдёӢеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәпјҢ然еҗҺжҚўдёҖдёӘзғ§жқҜеҶҚд»ҺдёӢеҸЈжҺҘеҮәдёҠеұӮж¶І в‘ӨеҸҜз”ЁдёҒиҫҫе°”е®һйӘҢйүҙеҲ«ж°ўж°§еҢ–й“Ғиғ¶дҪ“е’Ңж°ҜеҢ–й“Ғжә¶ж¶І в‘ҘеңЁиҝӣиЎҢиҝҮж»Өж“ҚдҪңж—¶пјҢдёәдәҶеҠ еҝ«иҝҮж»ӨйҖҹзҺҮпјҢеҸҜз”ЁзҺ»з’ғжЈ’дёҚж–ӯжҗ…жӢҢиҝҮж»ӨеҷЁдёӯж¶ІдҪ“ в‘Ұй…ҚзҪ®дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„NaOHжә¶ж¶Іе°ҶNaOHеӣәдҪ“еңЁзғ§жқҜдёӯжә¶и§ЈпјҢжүҖеҫ—жә¶ж¶ІеҶ·еҚҙеҲ°е®Өжё©пјҢеҶҚиҪ¬з§»иҮіе®№йҮҸ瓶дёӯ В В В AгҖҒв‘ в‘ўв‘Јв‘ҘВ В В В В В В В BгҖҒв‘ в‘Ўв‘ўв‘Өв‘ҘВ В В В В В В В В CгҖҒв‘ўв‘Јв‘Өв‘ҘВ В В В В В В DгҖҒв‘ в‘Ўв‘ўв‘Јв‘Ҙ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
FeC13ВӯВӯгҖҒCuCl2зҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…Ҙй“ҒзІүпјҢе……еҲҶеҸҚеә”еҗҺд»ҚжңүеӣәдҪ“еӯҳеңЁпјҢеҲҷдёӢеҲ—еҲӨж–ӯдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҠ е…ҘKSCNжә¶ж¶ІдёҖе®ҡдёҚеҸҳзәўиүІВ В В В В В В В В В В В В В BпјҺжә¶ж¶ІдёӯдёҖе®ҡеҗ«Fe2+ CпјҺжә¶ж¶ІдёӯдёҖе®ҡдёҚеҗ«Cu2+ В В В В В В В В В В В В В В В В В В В В В В В В DпјҺеү©дҪҷеӣәдҪ“дёӯдёҖе®ҡеҗ«Cu
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | ||||
|
зЎқй…ёй“ңжҳҜеҲ¶еӨҮCu-Zn-Alзі»еӮ¬еҢ–еүӮзҡ„йҮҚиҰҒеҺҹж–ҷпјҢеҲ¶еҸ–зЎқй…ёй“ңзҺ°жңүдёүз§Қи®ҫи®Ўж–№жЎҲеҸҜдҫӣйҖүз”Ёпјҡ в‘ CuдёҺзЁҖзЎқй…ёеҸҚеә”еҲ¶еҸ–пјҡ3Cu+8HNO3=3CuпјҲNO3пјү2+2NOвҶ‘+4H2O в‘ЎCuдёҺжө“зЎқй…ёеҸҚеә”еҲ¶еҸ–пјҡCu+4HNO3=CuпјҲNO3пјү2+2NO2вҶ‘+2H2O в‘ўйҖҡж°§ж°”дәҺй“ңеұ‘дёҺзЁҖзЎқй…ёзҡ„дҪ“зі»дёӯеҲ¶еҸ–пјҡ2Cu+4HNO3+O2=2CuпјҲNO3пјү2+2H2O дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
|
|||||
| 16. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||||||
|
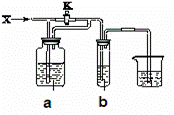
еҰӮеӣҫиЈ…зҪ®пјҢеңЁе…ій—ӯжҙ»еЎһKж—¶йҖҡе…Ҙж°”дҪ“XпјҢbдёӯжә¶ж¶ІжІЎжңүжҳҺжҳҫзҺ°иұЎпјӣејҖеҗҜжҙ»еЎһKйҖҡе…Ҙж°”дҪ“XпјҢеҲҷbдёӯжә¶ж¶ІжңүжҳҺжҳҫзҺ°иұЎпјҢдёӢеҲ—еҲӨж–ӯдёӯеҗҲзҗҶзҡ„жҳҜпјҲгҖҖгҖҖпјү
|
||||||||||||||||||||||||||||||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ14пҪҮй“ҒзІүжә¶дәҺ1пј¬зЁҖзЎқй…ёдёӯжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢж”ҫеҮәпј®пјҜж°”дҪ“еҗҺз§°йҮҸжүҖеҫ—жә¶ж¶ІпјҢеҸ‘зҺ°жҜ”еҺҹжә¶ж¶ІиҙЁйҮҸеўһеҠ 8g,еҲҷеҺҹжә¶ж¶ІдёӯзЎқй…ёзҡ„жә¶еәҰдёә(гҖҖгҖҖ) A.0.4пҪҚпҪҸL/lВ В В В В В В B.0.6пҪҚпҪҸL/lВ В В В В В В CпјҺ0.8пҪҚпҪҸL/lВ В оҖ„DпјҺ1.0пҪҚпҪҸL/l
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷе……жңүm mLNO е’Ңn mLNO2зҡ„йҮҸзӯ’еҖ’з«ӢдәҺж°ҙж§ҪдёӯпјҢ然еҗҺйҖҡе…Ҙm mL O2пјҢиӢҘm<nпјҢеҲҷе……еҲҶеҸҚеә”еҗҺйҮҸзӯ’еҶ…ж°”дҪ“дҪ“з§ҜпјҲmLпјүдёә(гҖҖгҖҖ)
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘100mL NaOHжә¶ж¶ІдёӯйҖҡе…ҘдёҖе®ҡйҮҸзҡ„CO2ж°”дҪ“пјҢе……еҲҶеҸҚеә”еҗҺпјҢеҶҚеҗ‘жүҖеҫ—жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙ0.2mol/Lзҡ„зӣҗй…ёпјҢдә§з”ҹCO2зҡ„дҪ“з§ҜдёҺжүҖеҠ зӣҗй…ёдҪ“з§Ҝд№Ӣй—ҙе…ізі»еҰӮеӣҫжүҖзӨәпјҺ дёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)В В В В В В В В В В В В В В В В В В В AпјҺеҺҹNaOHжә¶ж¶Ізҡ„жө“еәҰдёә0.1mol/LВ В BпјҺйҖҡе…ҘCO2зҡ„дҪ“з§Ҝдёә448mL CпјҺжүҖеҫ—жә¶ж¶Ізҡ„жә¶иҙЁжҲҗеҲҶзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәпјҲNaOHпјүпјҡпјҲNa2CO3пјү=1пјҡ3 DпјҺжүҖеҫ—жә¶ж¶Ізҡ„жә¶иҙЁжҲҗеҲҶзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәпјҲNaHCO3пјүпјҡпјҲNa2CO3пјү=2пјҡ1
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘дёҖе®ҡйҮҸзҡ„FeOгҖҒFeгҖҒFe3O4зҡ„ж··еҗҲзү©дёӯеҠ е…Ҙ100 mL 1 mol/Lзҡ„зӣҗй…ёпјҢжҒ°еҘҪдҪҝж··еҗҲзү©е®Ңе…Ёжә¶и§ЈпјҢж”ҫеҮә224 mL(ж ҮеҮҶзҠ¶еҶө)зҡ„ж°”дҪ“пјҢеңЁжүҖеҫ—жә¶ж¶ІдёӯеҠ е…ҘKSCNжә¶ж¶Іж— иЎҖзәўиүІеҮәзҺ°гҖӮиӢҘз”Ёи¶ійҮҸзҡ„COеңЁй«ҳжё©дёӢиҝҳеҺҹзӣёеҗҢиҙЁйҮҸзҡ„жӯӨж··еҗҲзү©пјҢиғҪеҫ—еҲ°й“Ғзҡ„иҙЁйҮҸжҳҜ(гҖҖгҖҖ) В В AпјҺ11.2 g В В В В В В В В BпјҺ5.6 gВ В В В В В В В В В В В В CпјҺ2.8 gВ В В В В В В В В В В В В DпјҺж— жі•и®Ўз®—
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗдёҖеҸҚеә”дҪ“зі»жңүеҸҚеә”зү©е’Ңз”ҹжҲҗзү©е…ұдә”з§Қзү©иҙЁпјҡO2гҖҒCr(OH)3гҖҒH2CrO4гҖҒH2OгҖҒH2O2гҖӮе·ІзҹҘиҜҘеҸҚеә”дёӯH2O2еҸӘеҸ‘з”ҹеҰӮдёӢиҝҮзЁӢпјҡH2O2вҶ’O2 пјҲ1пјүиҜҘеҸҚеә”дёӯзҡ„иҝҳеҺҹеүӮжҳҜ_________________ пјӣ пјҲ2пјүиҜҘеҸҚеә”дёӯеҸ‘з”ҹиҝҳеҺҹеҸҚеә”зҡ„иҝҮзЁӢжҳҜВ В В В В В В В В В вҶ’ __________В пјӣВ В В В В В пјҲ3пјүеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ_________________ пјӣ пјҲ4пјүеҰӮжһңеҸҚеә”дёӯиҪ¬з§»дәҶ0.3molз”өеӯҗпјҢеҲҷдә§з”ҹзҡ„ж°”дҪ“еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§ҜдёәВ В В В В В В В В L пјҲ5пјүK2Cr2O7 + 14HCl = 2KCl+ 2CrCl3 + 3Cl2вҶ‘+7H2OеҸҚеә”дёӯпјҢеҪ“жңү14.6gHClиў«ж°§еҢ–ж—¶пјҢз”өеӯҗиҪ¬з§»зҡ„ж•°зӣ®дёә_____________гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYгҖҒZгҖҒWжҳҜдёӯеӯҰеҢ–еӯҰдёӯеёёи§Ғзҡ„еӣӣз§Қж°”дҪ“пјҺе·ІзҹҘпјҡXгҖҒYгҖҒZдёүз§Қж°”дҪ“йғҪиғҪеҜ№еӨ§ж°”йҖ жҲҗжұЎжҹ“пјҢеңЁе·ҘдёҡдёҠйғҪеҸҜд»Ҙз”Ёзўұж¶Іеҗёж”¶пјӣXжҳҜеҢ–зҹізҮғж–ҷзҮғзғ§зҡ„дә§зү©д№ӢдёҖпјҢжҳҜеҪўжҲҗй…ёйӣЁзҡ„зү©иҙЁпјӣYжҳҜдёҖз§ҚеҚ•иҙЁпјҢе®ғзҡ„ж°ҙжә¶ж¶Іе…·жңүжјӮзҷҪдҪңз”ЁпјӣZжҳҜзЎқй…ёе·Ҙдёҡзҡ„жұҪиҪҰе°ҫж°”дёӯзҡ„жңүе®ізү©иҙЁд№ӢдёҖпјҢиғҪдёҺж°ҙеҸҚеә”пјӣWж°”дҪ“зҡ„ж°ҙжә¶ж¶Іж»ҙе…Ҙй…ҡй…һеҸҳзәўиүІпјҺиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
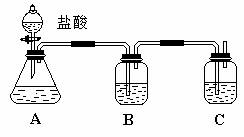
дёәзЎ®и®ӨHClгҖҒH2CO3гҖҒH2SiO3дёүз§Қй…ёзҡ„й…ёжҖ§ејәејұпјҢжҹҗеҗҢеӯҰи®ҫи®ЎдәҶеҰӮеӣҫжүҖзӨәзҡ„иЈ…зҪ®пјҢйҖҡиҝҮдёҖж¬Ўе®һйӘҢеҚіеҸҜиҫҫеҲ°зӣ®зҡ„гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳ:
пјҲ1пјүй”ҘеҪўз“¶дёӯиЈ…жңүжҹҗеҸҜжә¶жҖ§жӯЈзӣҗжә¶ж¶ІпјҢиҜҘзӣҗеҸҜд»ҘжҳҜВ В В В В В В В В В В В В В гҖӮ пјҲ2пјүиЈ…зҪ®BдёӯжүҖзӣӣзҡ„иҜ•еүӮдёәВ В В В В В В В В В В В В пјҢе…¶дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүиЈ…зҪ®CдёӯжүҖзӣӣзҡ„иҜ•еүӮжҳҜВ В В В В В В В В В В В жә¶ж¶ІпјҢCдёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В гҖӮВ пјҲ4пјүиҜҘе®һйӘҢдёӯжүҖз”ЁзЁҖзӣҗй…ёжҳҜз”Ёжә¶иҙЁиҙЁйҮҸеҲҶж•°дёә36.5%пјҢеҜҶеәҰдёә1.2gВ·mLпјҚ1зҡ„жө“зӣҗй…ёй…ҚеҲ¶зҡ„пјҢж¬Із”ЁиҜҘжө“зӣҗй…ёй…ҚеҲ¶жҲҗжө“еәҰдёә0.5 mol/Lзҡ„зЁҖзӣҗй…ё100mLгҖӮ в‘ В жүҖйңҖд»ӘеҷЁйҷӨзғ§жқҜгҖҒзҺ»з’ғжЈ’еӨ–иҝҳйңҖ __________гҖҒ __________гҖҒ __________гҖӮ в‘ЎВ з”Ёв‘ дёӯжүҖйҖүд»ӘеҷЁйҮҸеҸ–жө“зӣҗй…ёзҡ„дҪ“з§Ҝдёә_______mLгҖӮВ дёӢеҲ—ж“ҚдҪңдјҡеј•иө·жүҖй…Қжә¶ж¶Іжө“еәҰеҒҸй«ҳзҡ„жҳҜ______пјҺ В В В В В В В В В В В В В В A.еҸ–жө“зӣҗй…ёж—¶дҝҜи§Ҷ В В B.йҮҸеҸ–жө“зӣҗй…ёеҗҺпјҢжҠҠйҮҸзӯ’жҙ—ж¶Ө2вҖ”3ж¬ЎпјҢ并е°Ҷжҙ—ж¶Өж¶ІиҪ¬з§»иҮіе®№йҮҸ瓶дёӯ В C.е®ҡе®№ж—¶дҝҜи§Ҷ В D. йў еҖ’ж‘ҮеҢҖеҗҺеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝпјҢдҪҶжңӘеҠ ж°ҙиҮіеҲ»еәҰзәҝ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
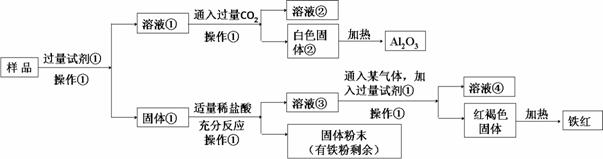
зәҜеҮҖзҡ„ж°§еҢ–й“қеёёз”ЁдҪңиҖҗзҒ«жқҗж–ҷпјҢеҸҲжҳҜзәўе®қзҹіпјҢи“қе®қзҹізҡ„дё»иҰҒжҲҗеҲҶгҖӮе·ІзҹҘжҹҗAl2O3ж ·е“Ғдёӯеҗ«жңүдёҖе®ҡйҮҸзҡ„CuгҖҒFeгҖҒFe2O3жқӮиҙЁгҖӮзҺ°йҖҡиҝҮдёӢеҲ—з”ҹдә§иҝҮзЁӢпјҢд»ҺиҜҘж ·е“ҒдёӯжҸҗзәҜAl2O3пјҢ并еӣһ收й“ҒзәўгҖӮжөҒзЁӢеҰӮдёӢпјҡ
пјҲ1пјүж“ҚдҪңв‘ зҡ„еҗҚз§°жҳҜ_________гҖӮ пјҲ2пјүиҜ•еүӮв‘ жҳҜ_________пјҢж ·е“ҒдёӯеҠ е…ҘиҝҮйҮҸиҜ•еүӮв‘ ж—¶еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ________гҖӮ пјҲ3пјүжә¶ж¶Ів‘ўдёӯй“Ғе…ғзҙ зҡ„еӯҳеңЁеҪўејҸжҳҜ_________________пјҢеҰӮдҪ•з”Ёе®һйӘҢиҜҒжҳҺпјҡ __В В В В В В В В ____ пјҲ4пјүжә¶ж¶Ів‘ўдёӯйҖҡе…Ҙжҹҗж°”дҪ“пјҢиҜҘж°”дҪ“еҸҜд»ҘжҳҜ_________пјҲд»»еҶҷдёҖз§Қзҡ„еҢ–еӯҰејҸпјүпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ_______________________________________В пјҲ5пјүиӢҘеҸ–50.0mLжҹҗжө“еәҰзҡ„иҜ•еүӮв‘ дёҺ50.0mL2.00molВ·L-1зҡ„AlCl3жә¶ж¶Ізӣёж··еҗҲпјҢжңүзҷҪиүІжІүж·Җдә§з”ҹпјҢжөӢеҫ—жә¶ж¶Ідёӯй“қе…ғзҙ дёҺжІүж·Җдёӯй“қе…ғзҙ иҙЁйҮҸзӣёзӯүпјҢеҲҷAжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә В В В В В В В В molВ·L-1
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
В жңүдёҖ瓶жҫ„жё…зҡ„жә¶ж¶ІпјҢе…¶дёӯеҸҜиғҪеҗ«жңү HпјӢгҖҒNH4пјӢгҖҒNaпјӢгҖҒAl3пјӢгҖҒFe3пјӢгҖҒIпјҚгҖҒ CO32пјҚгҖҒSO42пјҚгҖҒAlO2пјҚгҖӮеҸ–иҜҘжә¶ж¶ІиҝӣиЎҢд»ҘдёӢе®һйӘҢпјҡ в‘ з”ЁpHиҜ•зәёжЈҖйӘҢпјҢжә¶ж¶Іе‘Ҳејәй…ёжҖ§гҖӮ в‘ЎеҸ–жә¶ж¶ІйҖӮйҮҸпјҢеҠ е…Ҙе°‘йҮҸCCl4е’Ңж•°ж»ҙж–°еҲ¶ж°Ҝж°ҙпјҢжҢҜиҚЎпјҢCCl4еұӮе‘Ҳзҙ«зәўиүІгҖӮ в‘ўиҜҘжә¶ж¶Ізҡ„з„°иүІеҸҚеә”жІЎжңүй»„иүІпјӣ в‘ЈеҪ“еҗ‘иҜҘжә¶ж¶ІдёӯеҠ е…Ҙжҹҗжө“еәҰзҡ„NaOHжә¶ж¶Іж—¶пјҢеҸ‘зҺ°з”ҹжҲҗжІүж·Җзҡ„зү©иҙЁзҡ„йҮҸйҡҸNaOHжә¶ж¶Ізҡ„дҪ“з§ҜеҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮ пјҲ1пјүиҜҘжә¶ж¶ІдёӯиӮҜе®ҡеҗ«жңүзҡ„зҰ»еӯҗжҳҜ_______________________________________ е·ІзЎ®е®ҡйҳізҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә___________________________________________ пјҲ2пјүиӮҜе®ҡдёҚеҗ«зҡ„зҰ»еӯҗжҳҜ_________________________________________________гҖӮ пјҲ3пјүдёҚиғҪзЎ®е®ҡзҡ„зҰ»еӯҗжҳҜ_________пјҢ пјҲ4пјүиҜ·еҶҷеҮәжІүж·Җжә¶и§ЈиҝҮзЁӢзҡ„зҰ»еӯҗж–№зЁӢејҸ______________________________________В В В В В В В В В В |
|
- жүҝеҫ·еёӮй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·ж‘ёеә•иҖғиҜ•йўҳ
- й«ҳдёҖ7жңҲеӯҰжғ…жөӢиҜ•еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙеұұдёңзңҒжөҺеҚ—еёӮпјү
- д№җеұұеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·ж‘ёеә•иҖғиҜ•йўҳ
- 2018-2019е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲж№–еҚ—зңҒеІійҳіеҺҝ第дёҖдёӯеӯҰгҖҒжұЁзҪ—еёӮдёҖдёӯпјү
- йҖҡиҫҪе®һйӘҢдёӯеӯҰ2019е№ҙй«ҳдәҢеҢ–еӯҰдёӢеӯҰжңҹжңҲиҖғжөӢйӘҢеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- й«ҳдәҢдёӢеӯҰжңҹ第дёүж¬Ўйҳ¶ж®өжөӢиҜ•еҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№ пјҲ2019-2020е№ҙеұұдёңзңҒдёҙжІӮеёӮ第дёҖдёӯеӯҰпјү
- иҫҪе®ҒзңҒ2021еұҠй«ҳдёүж–°й«ҳиҖғ11жңҲиҒ”еҗҲи°ғз ”еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- еӨҮиҖғзӘҒз ҙй«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ ж‘ёеә•иҖғиҜ•йўҳ