2018-2019年高一上半期期末考试化学考试(湖南省岳阳县第一中学、汨罗市一中)
| 1. 选择题 | 详细信息 |
|
下列一步转化中,一定要加入氧化剂才能实现的是( ) A. SiO2―→Na2SiO3 B. Na2O2―→NaOH C. N2―→NH3 D. NH3―→NO |
|
| 2. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值,下列有关NA的叙述中,正确的是 ( ) A. 1 mol NaHCO3晶体中所含的离子总数为3NA B. 常温下,46gNO2与N2O4混合气体中所含的N原子数为NA C. 标准状况下,22.4L水中所含的H2O分子数为NA D. 在钠与过量氧气的反应中,1 mol 钠失去电子的数目为2NA |
|
| 3. 选择题 | 详细信息 |
|
一定量的Na2O2与CO2反应,得到固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应。下列说法正确的是( ) A. 41.8 g固体物质为Na2CO3 B. 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物 C. 一定量的Na2O2为78 g D. 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物 |
|
| 4. 选择题 | 详细信息 |
|
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42﹣)=0.8mol/L,则c(K+)为( ) A. 0.15 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L |
|
| 5. 选择题 | 详细信息 |
|
“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料分散到水中,得到的分散系不可能具有下列性质中的( ) A. 能全部通过半透膜 B. 能全部通过滤纸 C. 粒子做布朗运动 D. 能发生丁达尔效应 |
|
| 6. 选择题 | 详细信息 |
|
卫星发射时是以N2H4(联氨)和N2O4为火箭的动力源。反应温度高达2700 ℃,反应式为2N2H4+N2O4===3N2+4H2O。对于该反应的说法正确的是( ) A. 联氨是氧化剂 B. 氧化产物和还原产物的质量比为1∶2 C. 属于置换反应 D. 该反应的优点有热值高、无污染等 |
|
| 7. 选择题 | 详细信息 |
|
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是( ) A. 在该反应中维生素C作氧化剂 B. 由上述信息可推知砒霜中含有的砷是+3价 C. 因为河虾中含有砷元素,所以不能食用 D. 上述反应中河虾中的+5价砷被氧化 |
|
| 8. 选择题 | 详细信息 |
|
下列离子在对应的溶液中能大量共存的是( ) A. 在强酸性溶液中: CH3COO-、 NO3-、Fe2+、 Na+ B. 在能使酚酞试液变深红色的溶液中:Ca2+、 Ba2+、 NO3-、HCO3- C. 在含有Cl-、 Ba2+的溶液中:Na+、K+、HCO3-、NO3- D. 在无色透明溶液中:Ba2+、Fe3+、Mg2+、 Cl-、NO3- |
|
| 9. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 铁屑与稀硫酸反应:2Fe+6H+===2Fe3++3H2↑ B. FeCl3溶液腐蚀铜板:Fe3++Cu===Fe2++Cu2+ C. FeO与稀硝酸反应:FeO+2H+===Fe2++H2O D. Fe3O4与稀硝酸反应:3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O |
|
| 10. 选择题 | 详细信息 |
|
下列有关硅及其化合物的说法正确的是( ) A. 晶体硅具有金属光泽,可以导电,属于金属材料 B. 常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在 C. SiO2是一种酸性氧化物,能够与水反应生成相应的酸 D. 除去SiO2中混有的CaCO3可加入适量的稀盐酸后过滤 |
|
| 11. 选择题 | 详细信息 |
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是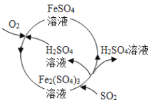 A.该过程中可得到化工产品H2SO4 B.该工艺流程是除去煤燃烧时产生的SO2 C.该过程中化合价发生改变的元素为Fe和S D.图中涉及到的反应之一为Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4 + 2H2SO4 |
|
| 12. 选择题 | 详细信息 |
|
类推的思维方法在化学学习与研宄中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否。下列几种类推结论中错误的是( ) ①钠与水反应生成NaOH和H2;高温下铁与水反应也生成碱和H2 ②氢氧化铝加热分解为金属氧化物和水;氢氧化镁、氢氧化铁也能加热分解生成相应的金属氧化物和水 ③碳酸钠、碳酸氢钠溶液均显碱性;钠盐溶液均能使酚酞变红 ④铝和硫反应生成Al2S3;铁与硫反应生成Fe2S3 A. ③④ B. ①③④ C. ②④ D. ①②③ |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
有下列三个反应: ①Cl2+FeI2=FeCl2+I2 ②2Fe2++Br2=2Fe3++2Br- ③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O 下列说法正确的是( ) A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2 B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3 C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2 |
|
| 15. 选择题 | 详细信息 |
下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( ) A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量 D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量 |
|
| 16. 选择题 | 详细信息 |
如右图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能( ) A. NaOH溶液、CO2 B. H2O、氨气 C. NaOH溶液、CO D. H2O、NO2 |
|
| 17. 填空题 | 详细信息 |
|
硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。 (1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目_________________ (2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是_________(填字母代号)。 A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol 产生的气体分别是_______________,其物质的量之比是_______________ (3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。___HNO3+_______→ _______+ _______ +___ NO↑+___H2O (4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______(填字母代号)。 A.Cu B.Cu C.Cu D.Cu |
|
| 18. 实验题 | 详细信息 |
某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。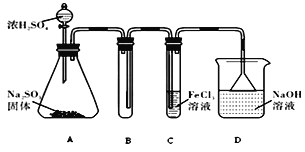 (1)A中的化学方程式为_______________________________________。 (2)通入足量SO2时C中观察到的现象为________________________________。 (3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。 ①写出SO2与FeCl3溶液反应的离子_________________________________。 ②请设计实验方案检验有Fe2+生成__________________________________。 ③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_______(填“合理”或“不合理”),理由是___________。 (4)D装置中倒置漏斗的作用是__________。 (5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________。 a.浓硫酸 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液 |
|
| 19. | 详细信息 |
铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。 讨论回答下列问题: (1)①中加盐酸后的沉淀主要是___________(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________(一种即可)。 (2)写出②、③中可能发生反应的离子方程式。 ②_______________________、________________、_______________________、________________。 ③_____________________、________________。 (3)步骤②中不用氨水沉淀Fe3+的原因:_____________。 |
|
| 20. 填空题 | 详细信息 |
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。 (1)A-B段的离子反应方程式为__________________________。 (2)原NaOH溶液的浓度为__________mol/L。 (3)通入CO2在标准状况下的体积为_______mL。 (4)所得溶液的溶质成分是_______________,其物质的量之比为_________。 |
|
最近更新



