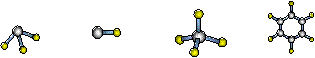上海市静安区2011届第二学期高三教学质量调研
| 1. | 详细信息 |
|
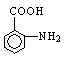
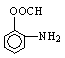
日本核电站附近检测到放射性原子131I。关于131I 原子和127I原子的叙述错误的是 A.它们互称为同位素 B.它们的化学性质几乎完全相同 C.它们相差4个质子 D.它们的电子数相同
|
|
| 2. | 详细信息 |
|
下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子层电子能量有差异的是 A.
|
|
| 3. | 详细信息 |
|
以下物质的工业制备所用主要原料(括号内物质)不符合事实的是 A.碘(海带) B.溴(海水晒盐后的余液) C.乙烯(乙醇) D.顺丁橡胶(石油裂解气)
|
|
| 4. | 详细信息 | |||
|
下列仪器名称规范、正确的是
A.三脚架 B.表面皿 C.镊子 D.瓷钳锅
|
||||
| 5. | 详细信息 |
|
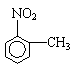
苹果联建公司用价格更低的正己烷代替酒精清洗电器零部件,已造成许多工人中毒。关于正己烷的叙述错误的是 A.属芳香烃 B.有毒 C.易挥发 D.难溶于水
|
|
| 6. | 详细信息 |
|
如右图,某同学将KClO3、浓盐酸、镁粉装进试管中,塞好胶塞,片刻后在管外点燃镁条,产生耀眼的白光,立即发现胶塞剧烈冲出。该同学的实验目的是 A.制取氢气并检验其纯度 B.制取氯气并检验其纯度 C.验证氯酸钾的氧化性 D.验证光对氢气和氯气反应的作用
|
|
| 7. | 详细信息 |
|
以下反应都有钠的化合物生成,其中不符合事实的是 A.Na2O2与水:NaOH B. NaNO3加热:NaNO2 C.金属钠与甲醇:CH3ONa D.NaNO3与浓硫酸微热制硝酸:Na2SO4
|
|
| 8. | 详细信息 |
|
以下物质的分离方法错误的是 A.将碘和四氯化碳分离:蒸馏 B.除去苯中混有的苯酚:加入浓溴水,过滤 C.煤焦油和粗氨水的分离:分液 D.分离溶液中微量的Fe3+ 和Cu2+:纸上层析
|
|
| 9. | 详细信息 |
|
对由X、Y元素形成的化合物X2Y2的叙述正确的是 A.若是离子化合物,则阳阴离子个数比肯定不等于1:1 B.若由分子构成且有Y-Y键,则肯定是非极性分子 C.若溶于水时有X-Y键的断裂,则肯定是强电解质 D.若X、Y原子间的共价键键能大,则熔、沸点肯定高
|
|
| 10. | 详细信息 |
|
如图,在置于空气的容器里盛有NaCl溶液,再放入缠绕铜丝的铁钉,下列叙述错误的是
A.铜丝上发生的反应为:O2+4e+2H2O→4OH- B.铁钉上发生的反应为:Fe-3e→Fe3+ C.NaCl的存在能加快铁钉的腐蚀速率 D.一段时间后铁钉上出现红棕色物质
|
|
| 11. | 详细信息 |
|
NA表示阿伏加德罗常数,下列说法错误的是 A.质量为a g的R分子,其相对分子质量为aNA B.12g石墨含有NA个碳原子 C.31g白磷分子(P4)中含有6NA个共用电子对 D.30g葡萄糖含有NA个碳原子
|
|
| 12. | 详细信息 |
|
关于右图所示实验装置的叙述错误的是 A.将水准管上提,液面高于量气管且不下降,说明装置不漏气 B.可用来测定气体摩尔体积 C.可用来测定锌的相对原子质量 D.用CCl4代替水,测得氢气的体积更准确
|
|
| 13. | 详细信息 |
|
已知H+(aq)+OH-(aq) → H2O(l)+Q(Q>0)。若向三份等体积、 0.1000 mol/L NaOH溶液中分别加入:①稀醋酸 ②浓硫酸 ③稀硝酸,至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3(单位:kJ)。下列关系式中正确的是 A.Q1>Q3>Q2 B.Q1>Q2>Q3 C.Q2>Q3>Q1 D.Q3 = Q2>Q1
|
|
| 14. | 详细信息 |
|
已知-NH2呈碱性,-CONH2呈中性。分子式均为C7H7O2N的以下有机物,对其性质判断正确的是
①甲物质既有酸性又有碱性 ②乙物质只有碱性 ③丙物质只有酸性 ④丁物质既不显酸性又不显碱性 A.①②③④ B.①②③ C.①③④ D.①②④
|
|
| 15. | 详细信息 |
|
氯元素的相对原子质量为35.5,由23Na、35Cl、37Cl构成的11.7g氯化钠中,37Cl的质量为 A.1.75g B.1.85 g C.5.25 g D.5.85g
|
|
| 16. | 详细信息 |
|
10克Fe2O3、SiO2、Al2O3混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积如右图。以下叙述错误的是
A.滤出的物质为SiO2 B.可求出x的值 D.可求出Fe2O3的质量分数
|
|
| 17. | 详细信息 |
|
25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是 A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+) + c(M+)=c(OH-) + c(A-) B.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH) D.pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
|
|
| 18. | 详细信息 |
|
在铜催化和加热的条件下,用苯甲醇制得了苯甲醛,同时还有氢气生成。分离出铜后,检验该苯甲醛是否是纯净物可用的方法是 A.定量分析--测熔点 B.定性分析--酸性高锰酸钾溶液 C.定量分析--银氨溶液 D.定性分析--新制氢氧化铜
|
|
| 19. | 详细信息 |
|
下列离子方程式中正确的是 A.向KAl(SO4)2溶液中加入Ba(OH)2至SO42–完全沉淀: 2Ba2+ + 4OH- + Al3+ + 2SO42-→2BaSO4↓+ AlO2-+ 2H2O B.用硫酸铜溶液吸收硫化氢气体: Cu2++S2-→CuS↓ C.过量的Al2(SO4)3溶液加入NaAlO2溶液中: A13++3AlO2-+6H2O→4A1(OH)3↓ D.向NaHCO3溶液中加入过量的Ba(OH)2溶液: Ba2++2HCO3-+2OH-→ BaCO3↓+CO32-+2H2O
|
|
| 20. | 详细信息 | ||||||||||||||||||||||||||||
|
某学习小组根据化学知识和右上表的数据,设计了下表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子其中不合理的是 物质 电离常数和溶解度(25℃) C6H5OH Ki =1.28×10-10 S = 9.3g/100g水 H2CO3 Ki1 =4.3×10-7 Ki2 =5.6×10-11
|
|||||||||||||||||||||||||||||
| 21. | 详细信息 | ||||||||||
|
由于实验误差,确定物质的组成和结构时,常常需要将多个实验进行对照和分析才能得出正确结论。已知某脂肪酸(用R表示)有以下实验记录:
则以下关于R的结论肯定正确的是 A.R是一元羧酸 B.R分子含一个碳碳双键 C.R的相对分子质量约为278 D.R的分子式为C18H32O2
|
|||||||||||
| 22. | 详细信息 | |||||||||||||||
|
右表为元素周期表短周期的一部分。回答下列问题:
(1)E元素原子核外有2个未成对电子,这2个电子所处亚层的符号是 ;请从物质的类别、化合价二方面归纳该元素+4价氧化物的化学性质: 。 (2)请指出G的非金属性比E的非金属性强的事实(写3点) 。 (3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,且E离子的半径更大,请解释 。 (4)A与氢元素形成分子的空间结构可能是(选填序号) 。
a b c d
|
||||||||||||||||
| 23. | 详细信息 |
|
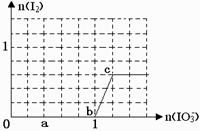
已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。 在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3
(1)写出a点反应的离子方程式 ; 反应中还原剂是 ;被还原的元素是 。 (2)写出b点到c点反应的离子方程式 。 (3)当溶液中的I-为0.4 mol时,加入的KIO3为 mol 。 (4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为 。
|
|
| 24. | 详细信息 | |||||||||||||||
|
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
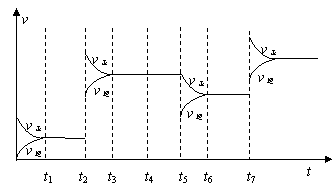
(1)固氮是指 的过程,自然界固氮的另一途径为 。 (2)根据表中的数据,并结合所学知识分析,下列说法正确的是 。 a.人类大规模模拟大气固氮实际意义很小 b.常温下,大气固氮与工业固氮完成程度相差很大 c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行 (3)为研究反应条件的改变对化学平衡移动的影响,将N2和H2在一固定体积的密闭容器中进行反应,得到如下的图像。下列有关条件改变(每次只改变一个条件)的说法,正确的是 。
b.t4可能是充入了He气 c.t5是从反应体系中分离出氨气 d.t7时可能是升高温度,使平衡向 正反应方向移动 (4)目前工业固氮采用的是哈伯法,即在 20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2 a.新法不需要高温条件,可节约大量能源 b.新法能在常温下进行是因为不需要断裂化学键 c.在相同温度下不同的催化剂其催化活性不同
|
||||||||||||||||
| 25. | 详细信息 | ||||||||||||||||||
|
我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
(1)称取100.000g A经过一系列处理(最后一步是在空气中灼烧)后,锰全部转变为某种氧化物,其质量为0.687g,则其化学式为 。 (2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数为 %。 (3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮。将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢 吨。 (4)某炼钢厂的烟尘成分和质量分数如下表:
为了减少烟尘的排放,将烟尘与CO混合后在空气中煅烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,铁的氧化物的组成和物质的量之比如何 (若无确定值,请表示某组分物质的量分数的取值范围)?
|
|||||||||||||||||||
| 26. | 详细信息 |
|
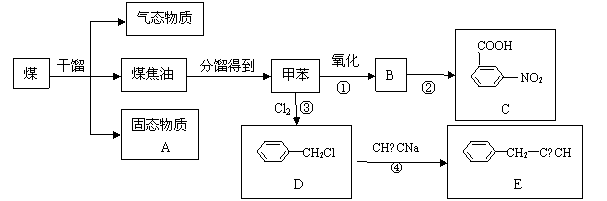
已知:苯环上连有的基团不同时,新的基团可能进入间位,也可能进入邻、对位。 煤是非再生能源,我国煤炭储量占能源总储量约94%。下图是煤干馏得到的主要产物,以及产物之一甲苯的有关反应。回答下列问题:
(1) 煤的干馏是指 。固态物质A是 (写名称),它是冶金工业的重要原料,还用于 (再写一种用途)。 (2)由甲苯制备物质C时,若反应①和②的顺序交换,得到的物质不是C,而可能是 (写结构简式,一种即可)。 (3)反应③的反应条件是 ;反应④是 反应(填反应类型)。 (4)与E含相同基团(苯基和—C≡C—)的E的同分异构体(包括E)共 种。
|
|
| 27. | 详细信息 |
|
钢铁生锈的过程十分复杂,已知某铁锈含有Fe2O3•nH2O(n≤1),还可能有Fe(OH)3和FeCO3。某学习小组做了以下实验: ①取12.574g铁锈隔绝空气加热至恒重,得到固体10.528g。 ②另取6.287g铁锈,在205.00 mL 1.000mol/L的稀硝酸中恰好完全溶解,产生NO气体89.60 mL(标准状况)。 (1)根据实验①,铁锈中是否只含Fe2O3•nH2O?试通过计算回答。 (2)根据实验②,能否确定铁锈中含有FeCO3?理由是什么? (3)若n=0.8,试通过计算确定6.287g铁锈的成分以及它们的物质的量。
|
|