2020西藏高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
右图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是 A.该反应是吸热反应 B.使用催化剂后反应热减小 C.热化学方程式为: CO(g)+2H2(g)=CH3OH(g)△H=-510kJ·mol-1 D.曲线a表示不使用催化剂时反应的能量变化, 曲线b表示使用催化剂后的能量变化
|
|
| 2. | 详细信息 |
|
一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g)
A.曲线a表示NO2的物质的量随反应时间的变化 B.0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1 C.10 s时,正、逆反应速率相等,达到平衡 D.20 s时,正反应速率大于逆反应速率
|
|
| 3. | 详细信息 |
|
某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是 A.该电池的正极材料为锌 B.该电池反应中二氧化锰发生了氧化反应 C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH- D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
|
|
| 4. | 详细信息 |
|
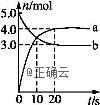
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2 B.加入BaCl2固体,可使溶液由a点变到c点 C.c点时,在T1、T2两个温度下均有固体析出 D.a点和b点的Ksp相等
|
|
| 5. | 详细信息 |
|
在一固定容积的密闭容器中,可逆反应:H2(g)+I2(g) A.混合气体的颜色不再发生变化 B.H2、I2、HI的分子数之比为1:1:2 C.单位时间生成n mol H2,同时消耗2n mol HI D.混合气体的密度保持不变
|
|
| 6. | 详细信息 |
|
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是 A.充电时的总反应为FePO4+Li=LiFePO4 B.充电时动力电池上标注“+”的电极应与外接电源的正极相连 C.放电时电池内部Li+向负极移动 D.放电时,在正极上是Li+得电子被还原
|
|
| 7. | 详细信息 |
|
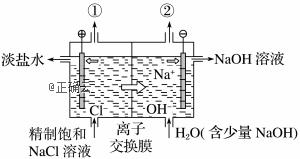
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
A.装置中出口①处的物质是氯气,出口②处的物质是氢气 B.该离子交换膜只能让阳离子通过,不能让阴离子通过 C.装置中发生反应的离子方程式为Cl-+2H+ D.该装置是将电能转化为化学能
|
|
| 8. | 详细信息 |
|
25 ℃时,水的电离达到平衡:H2O A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D.将水加热,KW增大,pH不变
|
|
| 9. | 详细信息 |
|
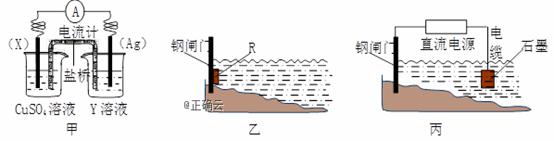
(1)依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。 ①电极X的材料是 ;Y溶液可以是 ; ②银电极上发生的电极反应式是 。 ③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是 (填离子符号)。 (2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。 ①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式 。 ②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。 A.铜 B.钠 C.锌 D.石墨 ③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的 极。
(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是: NiO2 + Fe + 2H2O ① 若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。 A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2 ② 该电池放电时,正极附近溶液的PH (填增大、减小、不变) ③ 充电时该电池阳极的电极反应式 。
|
|
| 10. | 详细信息 | ||||||||||||||||||||||||
|
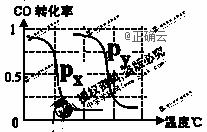
甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇: 反应I: CO(g)+2H2(g) 反应II: CO2(g)+3H2(g) (1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
①由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。 ②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)= mol·L-1·min-1,该温度下此反应的平衡常数为 ,此时的温度为 (从上表中选择)。 (2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是 。 A.升高温度 B.将CH3OH(g)从体系中分离 C.恒容条件下充入He D.再充入适量的 H2 (3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a=________、b=_______。 B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______MPa。 (4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知: ①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1 ②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1 则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
|
|||||||||||||||||||||||||
| 11. | 详细信息 | ||||||||||||
|
常温下,现有氨水和盐酸两溶液。回答以下问题: (1)若向氨水中加入少量硫酸铵固体,此时溶液中 (2)若向该氨水中加入氢氧化钠固体,则该电离平衡向 方向移动(分子化、离子化),电离平衡常数 。(增大、减小或不变) (3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈 性 (酸、碱、中) ;其原因用离子方程式表示为 。混合液中,c(NH4+)+c(NH3•H2O)= mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式 。 (4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
该滴定可以使用的指示剂是 ;达到滴定终点时的现象是 。 待测NaOH溶液的物质的量浓度为 mol/L。(保留四位有效数字)
|
|||||||||||||
| 12. | 详细信息 |
|
已知:在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。 用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下: ①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。 ②向滤液中通入Cl2,搅拌。 ③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。 ④把③所得滤液浓缩。 (1)①中加热并搅拌的目的是 。 (2)②中发生反应的离子方程式是 。 (3)③中的物质A可能是 ;调整的PH范围是 ; 过滤后滤渣的成分是 。 (4)③中发生反应的离子方程式是 。 (5)①③中如何用pH试纸测定溶液的pH值: 。
|
|