人教版高中化学同步练习
| 1. | 详细信息 |
|
下列叙述中不正确的是( ) A.铝的化学性质很活泼,在空气中极易锈蚀 B.铝是比较活泼的金属,在化学反应中容易失去电子,表现出还原性 C.铝条投入稀硫酸中生成无色气泡 D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
|
|
| 2. | 详细信息 |
|
镁、铝能够在空气中稳定存在的原因是( ) A.性质不活泼,不与空气中的成分反应 B.镁、铝与氧气的反应速率极慢 C.经过了特殊工艺处理 D.与氧气反应形成了氧化物保护膜
|
|
| 3. | 详细信息 |
|
铝是重要的金属材料之一,下列关于铝的叙述中不正确的是( ) A.铝原子最外层有3个电子 B.铝是地壳中含量最多的金属元素 C.在常温下,铝不能与氧气反应 D.铝易被氧化,而Al3+则很难被还原
|
|
| 4. | 详细信息 |
|
铝硅合金(Si的质量分数为13.5%)在凝固时收缩率很小,因而这种合金适合铸造。有下列三种晶体:①铝,②硅,③铝硅合金,它们的熔点由低到高的顺序是( ) A.①③② B.③①② C.③②① D.②①③
|
|
| 5. | 详细信息 |
|
下列叙述正确的是( ) A.钠与氧气反应时,产物是由O2的用量决定的 B.铝箔在空气中受热可以熔化且会发生剧烈燃烧 C.金属与非金属发生反应时,被氧化的一定是金属 D.铁丝不论在空气中还是在纯氧中都不会燃烧
|
|
| 6. | 详细信息 |
|
碲锌镉(Te-Zn-Cd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中错误的是( ) A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔沸点 B.它易导电、导热,具有延展性 C.它的熔沸点比Zn的低 D.它的硬度和强度比Cd的大
|
|
| 7. | 详细信息 |
|
若m g Al在足量氯气中燃烧,生成固体的质量为(m+21.3)g,将m g Al投入总质量为95.2 g NaOH水溶液中恰好完全反应。下列判断正确的是( ) A.m=2.7 B.Al与Cl2反应的产物溶于水,所得溶液中加入足量氨水,先出现白色沉淀,后又溶解 C.若在原NaOH溶液中通入足量Cl2,理论上可生成0.2 mol NaClO D.Al与NaOH溶液反应后所得溶液中溶质的质量分数为16.4%
|
|
| 8. | 详细信息 |
|
已知Al(OH)3能溶于NaOH溶液的离子方程式为Al(OH)3+OH-===AlO A.Al3+ B.AlO C.H+ D.HCO
|
|
| 9. | 详细信息 |
|
已知X是某金属单质,X、A、B、C含同一种元素,可发生如图转化:
(1)写出下列物质的化学式:X________,A________,B________,C________。 (2)写出以下反应的离子方程式: ②________________________________________________________________________。 ④________________________________________________________________________。
|
|
| 10. | 详细信息 |
|
Al(OH)3是不溶于水但能溶于NaOH溶液的白色固体,反应的离子方程式为Al(OH)3+OH-===AlO 甲:①白色结晶状粉末,可缓缓分解。②能溶于水。③遇酸及酸性药物则产生二氧化碳。④胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。 乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。②凝胶本身覆盖于溃疡面上,具有保护作用。③可溶于稀酸或氢氧化钠溶液中。 (1)请你推测,甲中含有的主要化学成分是__________(填化学式,下同);乙中含有的主要化学成分是________。 (2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:________________________________________________________________________。 (3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:________________________________________________________________________。
|
|
| 11. | 详细信息 |
|
某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色试验呈绿色)。 ①外观暗灰色,表皮光滑; ②在酒精灯上灼烧,火焰呈绿色,合金片熔化,但不滴落; ③取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L; ④另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。 (1)试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的下列元素是______(填标号)。 a.Ag b.Mg c.Na d.Fe (2)如果该合金中只含2种元素,则二者的质量比是________________。
|
|
| 12. | 详细信息 |
|
把10.2 g镁铝合金的粉末放入过量的烧碱中,得到6.72 L标准状况下的H2。试计算: (1)该合金中铝的质量分数为________。 (2)该合金中镁与铝的物质的量之比为________。 (3)该合金溶于足量的盐酸溶液中,产生H2的体积(标准状况下)为________。
|
|
| 13. | 详细信息 |
|
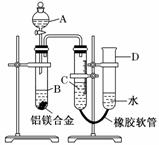
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为________。 (2)B中发生反应的化学方程式为__________________________________________。 (3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况下),B中剩余固体的质量为c g,则铝的相对原子质量为______________。 (4)实验过程中,若未洗涤过滤所得的不溶物,则测得的质量分数将________(填“偏大”“偏小”或“不受影响”)。
|
|