2018江苏高一下学期苏教版高中化学期中考试
| 1. | 详细信息 |
|
第三届联合国环境大会的主题为“迈向无污染的地球”。下列做法不应提倡的是 A. 推广电动汽车,践行绿色交通 B. 改变生活方式,预防废物生成 C. 回收电子垃圾,集中填埋处理 D. 弘扬生态文化,建设绿水青山
|
|
| 2. | 详细信息 |
|
分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是 A.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等 B.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 C.根据分散系是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 D.根据物质是否导电,将物质分为电解质和非电解质
|
|
| 3. | 详细信息 |
|
下列电离方程式不正确的是 A.Ba(OH)2=Ba2++2OH- B.FeSO4=Fe3++SO42- C.NaHSO4=Na++H++SO42- D.NaHSO4(熔融)=Na++HSO4-
|
|
| 4. | 详细信息 |
|
下列有关物质的性质与用途具有对应关系的是 A.过氧化钠能与水反应产生氧气,可用于高空飞行或潜水的供氧剂 B.氢氧化铝具有两性,可用作治疗胃酸过多的内服药 C.NaHCO3能与碱反应,可用作焙制糕点的膨松剂 D.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用作净化剂
|
|
| 5. | 详细信息 |
|
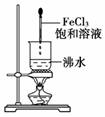
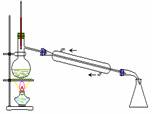
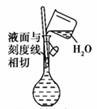
下列实验装置和操作都正确且能达到实验目的的是 图1 图2 图3 图4 A.用图1制备Fe(OH)3胶体 B.用图2分离碘酒中的碘和酒精 C.用图3制取少量蒸馏水 D.用图4配制一定物质的量浓度的溶液
|
|
| 6. | 详细信息 |
|
下列指定反应的离子方程式正确的是 A.铁跟稀盐酸反应:2Fe + 6H+=2Fe3+ + 3H2↑ B.硅酸钠溶液与盐酸反应:Na2SiO3 + 2H+=2Na++ H2SiO3↓ C.FeCl3溶液与Cu反应:Cu + Fe3+=Cu2++ Fe2+ D.NaHCO3溶液中加入足量Ba(OH)2溶液:HCO3-+ Ba2++ OH-=BaCO3↓+ H2O
|
|
| 7. | 详细信息 |
|
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过下列反应合成得到。 Al2O3+N2+3C 下列有关叙述正确的是 A.Al2O3是氧化剂 B.AlN中氮元素的化合价为+3 C.AlN的摩尔质量为41g D.每生成1 mol AlN,则有1.806×1024个电子转移
|
|
| 8. | 详细信息 |
|
科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是 A.探究Na与水反应可能生成NaOH和H2O2 B.探究Na与乙醇反应可能生成C2H5ONa和H2 C.探究Na与熔融氯化钾反应可能生成NaCl和K D.探究SO2与Na2O2反应可能有Na2SO4生成
|
|
| 9. | 详细信息 |
|
下列图示与对应的叙述相符合的是
甲 乙 丙 丁 A.图甲表示向含有Al3+、Mg2+、H+的溶液中滴加NaOH溶液 B.图乙表示向KAl(SO4)2溶液中滴加Ba(OH)2溶液 C.图丙表示向n(AlCl3)∶n(MgSO4)=1∶2的混合液中滴加NaOH溶液 D.图丁表示等物质的量的镁和铝分别与足量的等浓度、等体积的稀硫酸反应
|
|
| 10. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A.1mol Na与足量O2反应转移的电子数目为NA B.100 g 98%的浓硫酸中所含的氧原子数为4NA C.标准状况下,22.4 L CCl4含有的分子数为NA D.1mol·L-1CaCl2溶液中含有的Cl-离子数目为2NA
|
|
| 11. | 详细信息 |
|
下列实验操作或做法中,主要不是从安全因素考虑的是 A.装运浓硫酸的包装标签上印有右图警示标志 B.用CO还原氧化铁时,要先通一会儿CO气体,再加热氧化铁 C.萃取分液操作时,应将上层液体从分液漏斗的上口倒出 D.用镊子从煤油中取出金属钠,切下绿豆大小的备用,将剩余的放回原瓶
|
|
| 12. | 详细信息 |
|
.常温下,下列各组离子在指定溶液中一定能大量共存的是 A.无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl- B.使酚酞变红色的溶液中:K+、Na+、SO42-、CO32- C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- D.0.1 mol·L-1AgNO3溶液中:H+、K+、SO42-、Cl-
|
|
| 13. | 详细信息 | |||||||||||||||
|
下列有关物质检验的操作、现象及结论均正确的是
|
||||||||||||||||
| 14. | 详细信息 |
|
.制备新型高效水处理剂高铁酸钠(Na2FeO4)的主要反应为: 2FeSO4+aNa2O2=2Na2FeO4+2Na2O+2Na2SO4+bX 下列说法中正确的是 A.该反应中X为O2 B.反应物Na2O2只作氧化剂 C.该反应中发生氧化反应的过程只有FeSO4→Na2FeO4 D.每生成1 mol Na2FeO4,反应过程中转移5 mol e-
|
|
| 15. | 详细信息 |
|
实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是 A.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl B.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 C.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 D.称取2.74g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
|
|
| 16. | 详细信息 |
|
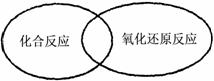
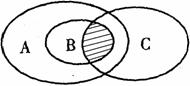
离子反应和氧化还原反应都是高中化学中重要的反应类型。回答下列问题: (1)在发生离子反应的反应物或生成物中,一定存在有 ▲ 。(填序号) ①单质 ②化合物 ③氧化物 ④酸 ⑤碱 ⑥盐 ⑦电解质 (2)人们常用图示法表示不同反应类型之间的关系,如化合反应和氧化还原反应的关系可用图1表示。图2为离子反应、氧化还原反应和置换反应三者之间的关系,则表示置换反应的是 ▲ (填字母),请写出符合图2阴影部分的一个化学方程式 ▲ 。
图1 图2 (3)离子方程式可以表示一类化学反应,但有些离子方程式却只能表示一个化学反应。下列离子方程式中,只能表示一个化学反应的是 ▲ 。(填字母) A.Ag++ Cl-=AgCl↓ B.Ba2++ 2OH-+ 2H++ SO C.Al(OH)3 + OH-=AlO2-+ 2H2O D.Cl2 + H2O = H++ Cl-+ HClO
|
|
| 17. | 详细信息 |
|
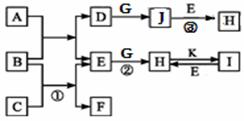
有关物质的转化关系如图所示(部分生成物和反应条件已略去)。常温常压下,D、F、K均为无色无刺激性气味的气体。C、G为常见金属单质;B是最常见的无色液体;A是由单质C在D中燃烧生成的淡黄色固体; G、I、J既能与强酸反应,又能与强碱反应。
请回答下列问题: (1)A的化学式为 ▲ 。 (2)K的摩尔质量为 ▲ 。 (3)反应①的离子方程式为 ▲ 。 (4)反应②的化学方程式为 ▲ 。 (5)反应③的离子方程式为 ▲ 。
|
|
| 18. | 详细信息 |
|
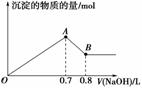
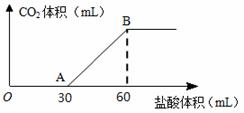
称取8.58g Na2CO3•xH2O溶于水配成溶液,然后逐滴滴入1mol/L的盐酸,所加入盐酸溶液的体积与产生的CO2气体体积(标准状况)的关系如图所示。
(1)分别写出OA、AB段所发生反应的离子方程式 ▲ 、 ▲ 。 (2)B点所产生的CO2的体积是 ▲ mL(标准状况)。 (3)计算Na2CO3•xH2O中x的值。(写出计算过程)
|
|
| 19. | 详细信息 |
|
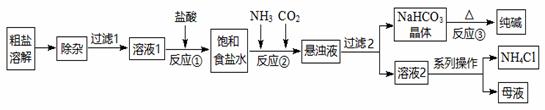
某厂以工业粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如图所示:
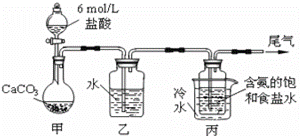
【查阅资料】氯化铵受热易分解:NH4Cl (1)“除杂”步骤中需加入两种试剂,按加入顺序写出化学式: ▲ 、 ▲ 。 (2)反应②的化学方程式是 ▲ 。 (3)“系列操作”包括 ▲ 、 ▲ 、过滤。 (4)不用其它试剂,检查NH4Cl产品是否纯净的实验方案是(请补充完整):取少量氯化铵产品于试管底部, ▲ ,表明氯化铵产品纯净。 (5)某化学兴趣小组模拟“侯氏制碱法”,实验装置如图所示。
①装置甲中的离子方程式是 ▲ 。 ②装置丙中冷水的作用是 ▲ 。
|
|
| 20. | 详细信息 |
|
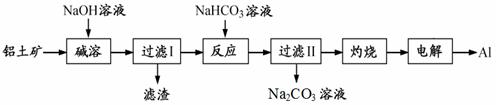
铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,假设只含Fe2O3杂质)为原料制备铝的一种工艺流程如下:
(1)“滤渣”的主要成分为 ▲ (填化学式)。 (2)加入NaHCO3溶液发生反应的离子方程式是 ▲ 。 (3)“灼烧”用到的主要仪器是 ▲ (填仪器名称)。 (4)电解熔融的氧化铝时,若得到标准状况下22.4LO2,则同时生成铝的质量为 ▲ g。 (5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 ▲ 。
|
|
| 21. | 详细信息 |
|
铬是水体的主要的污染物之一,可以导致水中生物死亡。化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如处理铬的实验循环示意图如下:
(1)在上述步骤中,需用氧化剂的是 ▲ (填编号)。 (2)反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式,并用“单线桥法”标出电子转移方向和数目。 (3)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 ▲ (填化学式)。 (4)铬的化合价除了示意图中涉及的+3和+6外,还有0、+2、+4和+5等。现有24mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应。已知Na2SO3被Na2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ▲ 。
|
|