2018宁夏高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
我国明代《本草纲目》中记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次…价值数倍也”。这里用到的实验操作方法是 A.萃取 B.蒸馏 C.分液 D. 过滤
|
|
| 2. | 详细信息 |
|
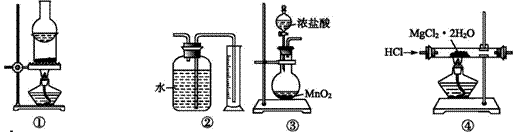
关于下列各装置的叙述中,正确的是
A.装置①可用于分离I2与NH4Cl的混合物 B.装置②用于收集并测量Cu与浓硫酸反应产生的气体的体积 C.装置③用于制取氯气 D.装置④用于制取无水MgCl2
|
|
| 3. | 详细信息 | |||||||||||||||
|
向含2 mol NaOH、1 mol Ba(OH)2、2 mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是
|
||||||||||||||||
| 4. | 详细信息 | ||||||||||||||||||||
|
根据下列实验操作和现象所得到的结论正确的是
|
|||||||||||||||||||||
| 5. | 详细信息 |
|
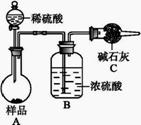
FeCl3易潮解、易升华,实验室制备FeCl3的装置如图所示(加热和夹持装置略去)。下列说法正确的是 A.导管g的作用是增强装置的气密性 B.试剂X和试剂Y分别为浓硫酸、饱和食盐水 C.直接用E接收产物比用导管连接的优点是可防止堵塞 D.F中浓硫酸的作用是防止G中氢氧化钠进入E
|
|
| 6. | 详细信息 |
|
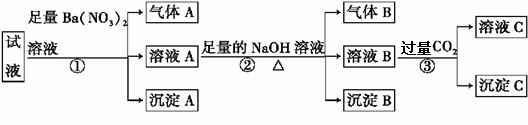
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验: 下列有关判断不正确的是 A.原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ B.原溶液中一定没有Ba2+、CO32-、NO3- C.步骤③中反应的离子方程式为2AlO2-+CO2+3H2O D.气体A、B之间能发生反应
|
|
| 7. | 详细信息 | ||||||||||||||||||||
|
下列各组物质中,任意两种物质在常温下均能发生反应的是
|
|||||||||||||||||||||
| 8. | 详细信息 | ||||||||||||
|
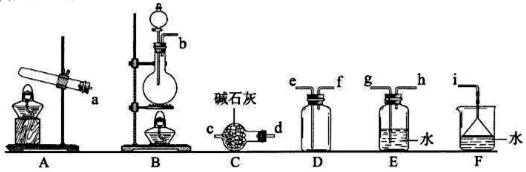
氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。 ②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应
|
|||||||||||||
| 9. | 详细信息 | ||||||||||||
|
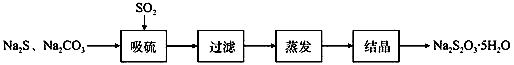
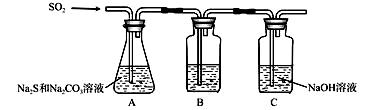
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为: 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。 ②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。(任写一条) (2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2),限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下: 第一步:准确称取a g KIO3(相对分子质量:214)固体配成溶液, 第二步:加入过量KI固体和H2SO4溶液,滴加指示剂, 第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为v mL。则c(Na2S2O3)=______mol·L-1。(只列出算式,不作运算) 已知:IO3-+I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-。甲同学盛装Na2S2O3溶液之前未润洗,这样测得的Na2S2O3的浓度可能 (填“无影响”、“偏低”或“偏高”);乙同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能 (填“无影响”、“ 偏低”或“偏高”)。
|
|||||||||||||
| 10. | 详细信息 |
|
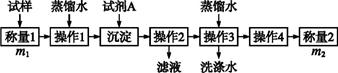
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可用以下四种方法。
方法二:
方法三: 方法四:不使用化学试剂,使用实验室常用仪器。 按要求回答下列问题: (1)方法一:加入足量的试剂A是 (填写A的化学式),可将HCO3-转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和干燥(烘干); (2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是 ,应选择甲基橙作指示剂; (3)在方法二中计算该样品中NaHCO3的质量分数为 ; (4)在方法三中,根据所用的实验装置,除了称量样品质量外,还需测定的实验数据是 ; (5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述); (6)方法四的实验原理是 (用化学方程式表示)。
|
|
| 11. | 详细信息 |
|
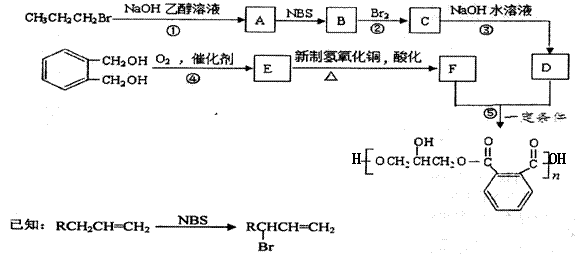
某树脂的合成线路如下:
(1)B中含有的官能团的名称是________________________。 (2)反应①、③的有机反应类型分别是________________、____________________。 (3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是 。 (4)下列说法正确的是__________(填字母编号)。 a.1 mol E与足量的银氨溶液反应能生成2mol Ag b.可以用NaHCO3鉴别E和F c.B分子存在顺反异构 (5)写出反应⑤的化学方程式______________________________________________。 (6) a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
|
|
| 12. | 详细信息 | ||||||||||||
|
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。 (1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。 (2)A元素的各级电离能如下:
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。 (3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。 (4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知: 该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。 ①该晶体的化学式为__________。 ②在该晶体中,A与C形成共价键的键长(d)为_____pm。
|
|||||||||||||