2018高二上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( ) ①加快化石燃料的开采与使用 ②研发易降解的生物农药 ③应用高效洁净的能源转换技术 ④田间焚烧秸秆 ⑤推广使用节能环保材料 A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
|
|
| 2. | 详细信息 |
|
下列变化属于吸热反应的是 ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥Ba(OH)2·8H2O与NH4Cl晶体混合 A.①④⑤ B.②④⑤ C.②③ D.②④⑥
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.活化分子间的碰撞一定发生化学反应 B.吸热反应只有加热才能发生 C.有能量变化的一定是化学反应 D.有化学键断裂不一定发生化学反应
|
|
| 4. | 详细信息 |
|
下列热化学方程式中,正确的是( ) A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3 kJ·mol-1 B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) C.HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1 D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H= -571.6 kJ·mol-1
|
|
| 5. | 详细信息 |
|
由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是 A.391.6 kJ/mol B.541.4kJ/mol C.700.2kJ/mol D.1174.7kJ/mol
|
|
| 6. | 详细信息 |
|
已知反应4CO+2NO2 A.v(CO)=1.5 mol·L-1·min-1 B.v(NO2)=0.7 mol·L-1·min-1 C.v(N2)=0.4 mol·L-1·min-1 D.v(CO2)=1.1 mol·L-1·min-1
|
|
| 7. | 详细信息 |
|
用2g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( ) ①再加入30mL3mol/L盐酸②改用30mL6mol/L盐酸③改用2g粉末状大理石④适当升高温度. A.①②④ B.②③④ C.①③④ D.①②③
|
|
| 8. | 详细信息 |
|
|
|
| 9. | 详细信息 |
|
容积固定的密闭容器中,达平衡的可逆反应2A(g) A、B和C可能都是液体 B、B和C肯定都是气体 C、B和C可能都是固体 D、若C为固体,则B一定是气体。
|
|
| 10. | 详细信息 |
|
在密闭容器中发生下列反应aA(g) A.A的转化率变大 B.平衡向正反应方向移动 C.D的体积分数变大 D.a<c+d
|
|
| 11. | 详细信息 |
|
A.其他条件不变,仅将容器的体积缩小一半,反应速率减小 B.其他条件不变,升高温度,反应速率加快且H2O(g)转化率增大 C.保持体积不变,充入少量He使体系压强增大,反应速率一定增大 D.其他条件不变,适当增加C(s)的质量会使反应速率增大
|
|
| 12. | 详细信息 |
|
下列措施或事实不能用勒夏特列原理解释的是( ) A.新制的氯水在光照下颜色变浅 B.H2、I2、HI平衡混合气加压后颜色变深 C.在合成氨的反应中,降温或加压有利于氨的合成 D.红棕色NO2 加压后颜色先变深后变浅
|
|
| 13. | 详细信息 |
|
在密闭容器中,一定条件下进行如下反应: NO(g)+CO(g) 达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( ) A.加催化剂同时升高温度 B.加催化剂同时增大压强 C.升高温度同时充入N2 D.降低温度同时减小压强
|
|
| 14. | 详细信息 |
|
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) A.x=1 B.B的转化率为50% C.2min内A的反应速率为0.3mol·L-1·min-1 D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
|
|
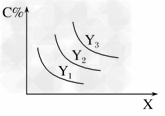
| 15. | 详细信息 |
|
对于反应A(s)+2B(g) A.Y表示温度,X表示压强,且Y3>Y2>Y1 B.Y表示压强,X表示温度,且Y3>Y2>Y1 C.X表示压强,Y表示温度,且Y1>Y2>Y3 D.X表示温度,Y表示压强,且Y1>Y2>Y3
|
|
| 16. | 详细信息 | ||||||||||||
|
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
A.反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y⇌2Z,其平衡常数为1600 C.改变温度可以改变此反应的平衡常数 D.增大压强使平衡向生成Z的方向移动,平衡常数增大
|
|||||||||||||
| 17. | 详细信息 | ||||||||||
|
断裂1 mol化学键所需的能量如下:
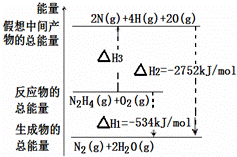
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( ) A.N2比O2稳定 B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 C.表中的a=194 D.图中的ΔH3=+2218 kJ·mol-1
|
|||||||||||
| 18. | 详细信息 |
|
下列关于判断过程的方向的说法正确的是 ( ) A.所有自发进行的化学反应都是放热反应 B.高温高压下可以使石墨转化为金刚石是自发的化学反应 C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 D.同一物质的固、液、气三种状态的熵值相同
|
|
| 19. | 详细信息 |
|
1)已知2 mol氢气燃烧生成液态水时放出572 kJ的热量,反应方程式是2H2(g)+O2(g)===2H2O(l)。请回答下列问题: ①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。 ②若2 mol氢气完全燃烧生成水蒸气,则放出的热量_____(填“大于”、“小于”或“等于”)572 kJ。 (2) 2.3g有机物C2H6O和一定量的氧气混合点燃,恰好完全燃烧,生成CO2和液态水,并放出68.35kJ热量,则该反应的热化学方程式是 。 (3) FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时: 2SO2(g)+O2(g) H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1 2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1 则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是 。 (5)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、________、量筒。量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是________(填序号)。 A.50 mL 0.50 mol·L-1 NaOH溶液 B.50 mL 0.55 mol·L-1 NaOH溶液 C.1.0 g NaOH固体
|
|
| 20. | 详细信息 | |||||||||
|
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
(1)过氧化氢分解的化学方程式为_____________________________________。 (2)实验①的目的是_________________________________________________。 实验中滴加FeCl3溶液的目的是_______________________________________。
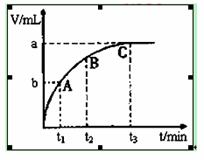
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最小的是___ ___。
|
||||||||||
| 21. | 详细信息 |
|
(1)把0.2mol X气体和0.4mol Y气体混合于2L密闭容器中,使它们发生如下反应: 4X(g)+5Y(g) == n Z(g)+6W(g);2min末生成0.3mol W。若测知Z的浓度变化表示的反应速率为0.05mol/(L·min)。计算: ①前2min内用Y 的浓度变化表示的反应速率为 ②化学方程式中n的值是 。 (2)在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡:2SO2+O2
①该反应的化学方程式为 ②下列叙述能说明上述反应达到平衡状态的是 。 A、混合气体的总物质的量不随时间的变化而变化 B、相同时间内消耗2n mol 的A的同时生成4n mol 的C C、混合气体的总质量不随时间的变化而变化 D、容器内压强不再发生变化
|
|
| 22. | 详细信息 |
|
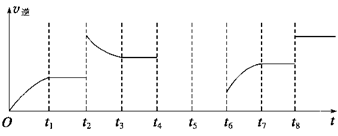
一定温度下,在容积固定的V L密闭容器中加入1 mol A、2 mol B,发生反应: A(g)+2B(g) (1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。 A.物质A、B的转化率之比为1∶2 B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x) C.当2v正(A)=v逆(B)时,反应一定达到平衡状态 D.充入惰性气体(如Ar),平衡向正反应方向移动 (2)K和x的关系满足K=__________(用含x的式子表示)。达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是____________(填字母序号)。 A.c(A)减少 B.正反应速率加快,逆反应速率减慢 C.C的物质的量增加 D.重新平衡时c(B)/c(C)减小 (3)该反应的逆反应速率与时间的关系如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件: t2时 ; t8时_________________。 ②t2时平衡向________(填“正反应”或“逆反应”)方向移动。 ③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
|
|
 反应
反应