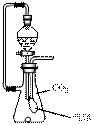2016жұҹиӢҸй«ҳдёүдёӢеӯҰжңҹиӢҸж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺе№іиЎЎдҪ“зі»2SO2(g) + O2(g) A. иӢҘжё©еәҰдёҚеҸҳпјҢе°Ҷе®№еҷЁзҡ„дҪ“з§ҜеўһеӨ§дёҖеҖҚпјҢжӯӨж—¶зҡ„SO2жө“еәҰеҸҳдёәеҺҹжқҘзҡ„0.48еҖҚ B. иӢҘе№іиЎЎж—¶SO2гҖҒO2зҡ„иҪ¬еҢ–зҺҮзӣёзӯүпјҢиҜҙжҳҺеҸҚеә”ејҖе§Ӣж—¶пјҢдёӨиҖ…зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2:1 C. иӢҘд»Һе№іиЎЎдҪ“зі»дёӯеҲҶзҰ»еҮәSO3пјҢеҲҷжңүеҲ©дәҺжҸҗй«ҳSO2зҡ„иҪ¬еҢ–зҺҮе’ҢеҠ еҝ«жӯЈеҸҚеә”йҖҹзҺҮ D. е№іиЎЎзҠ¶жҖҒж—¶SO2гҖҒO2гҖҒSO3зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёҖе®ҡдёә2:1:2
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
Q гҖҒXгҖҒYгҖҒZгҖҒWжҳҜе…ғзҙ е‘ЁжңҹиЎЁеүҚеӣӣе‘Ёжңҹдёӯзҡ„дә”з§Қеёёи§Ғе…ғзҙ пјҢе…¶зӣёе…ідҝЎжҒҜеҰӮдёӢиЎЁпјҡ
В В пјҲ1пјүYдҪҚдәҺе…ғзҙ е‘Ёжңҹ表第гҖҖгҖҖгҖҖе‘ЁжңҹиЎЁгҖҖгҖҖгҖҖж—ҸпјҢYе’ҢZзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„й…ёжҖ§иҫғејәзҡ„жҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖпјҲеҶҷеҢ–еӯҰејҸпјүгҖӮ В В пјҲ2пјүXY2жҳҜдёҖз§Қеёёз”Ёзҡ„жә¶еүӮпјҢXY2зҡ„еҲҶеӯҗдёӯеӯҳеңЁгҖҖгҖҖгҖҖдёӘПғй”®гҖӮеңЁHвҖ•YгҖҒHвҖ•ZдёӨз§Қе…ұд»·й”®дёӯпјҢй”®зҡ„жһҒжҖ§иҫғејәзҡ„жҳҜгҖҖгҖҖгҖҖгҖҖпјҢй”®й•ҝиҫғй•ҝзҡ„жҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮ В В пјҲ3пјүWзҡ„еҹәжҖҒеҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғејҸжҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖӮеңЁWзҡ„жҷ¶дҪ“з»“жһ„йҮҢпјҢй…ҚдҪҚж•°жҳҜВ В В В В В В В В пјӣ В В пјҲ4пјүQгҖҒXеҪўжҲҗзҡ„жңҖз®ҖеҚ•еҢ–еҗҲзү©йҮҢдёӯеҝғеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢжҳҜВ В В В В В В В В В В В В В В пјҢе…¶з©әй—ҙз»“жһ„дёәВ В В В В В В В В В В В В В В пјҢQдёҺж°§еҺҹеӯҗеҪўжҲҗзҡ„еҢ–еҗҲзү©йҮҢдёӯеҝғеҺҹеӯҗжқӮеҢ–зұ»еһӢдёҺдёҠиҝ°зү©иҙЁзӣёеҗҢпјҢдҪҶй”®и§’дёҚеҗҢпјҢе…¶еҺҹеӣ еҸҜиғҪжҳҜВ В В В В В В В В В В В В В пјӣ В В пјҲ5пјүеҶҷеҮәдёҺYO2дә’дёәзӯүз”өеӯҗдҪ“зҡ„дёҖз§ҚеҚ•иҙЁзҡ„еҲҶеӯҗејҸжҳҜВ В В В В В В В В В В В гҖӮ
|
|||||||||||||
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
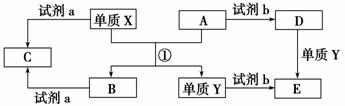
IпјҺXгҖҒYгҖҒZгҖҒMгҖҒNдёәзҹӯе‘Ёжңҹзҡ„дә”з§Қдё»ж—Ҹе…ғзҙ пјҢе…¶дёӯXгҖҒZеҗҢдё»ж—ҸпјҢYгҖҒZеҗҢе‘ЁжңҹпјҢMдёҺXпјҢYж—ўдёҚеҗҢж—ҸпјҢд№ҹдёҚеҗҢе‘ЁжңҹгҖӮXеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°жҳҜж ёеӨ–з”өеӯҗеұӮж•°зҡ„дёүеҖҚпјҢY пјҲ1пјүиҜ·еҶҷеҮәMзҡ„е…ғзҙ з¬ҰеҸ·пјҡ ____________пјҢZзҡ„еҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫпјҡ ____________гҖӮMдёҺXдёӨе…ғзҙ еҸҜеҪўжҲҗдёӨз§Қж¶ІжҖҒеҢ–еҗҲзү©пјҢе…¶еҢ–еӯҰејҸеҲҶеҲ«дёәВ В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиҜ·еҶҷеҮәNе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®В В В В В В В В В В В В В В пјӣдёҺNеҗҢж—Ҹзҡ„зҹӯе‘Ёжңҹе…ғзҙ LпјҢе…¶жңҖй«ҳд»·ж°§еҢ–зү©зҡ„з”өеӯҗејҸдёәВ В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүYдёҺZзӣёжҜ”пјҢйқһйҮ‘еұһжҖ§иҫғејәзҡ„е…ғзҙ жҳҜ___пјҢпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүеҸҜд»ҘиҜҒжҳҺиҜҘз»“и®әзҡ„е®һйӘҢдәӢе®һжҳҜВ В В В В В В В гҖӮ IIпјҺдёӢеҲ—иҪ¬еҢ–е…ізі»дёӯпјҢXгҖҒYжҳҜз”ҹжҙ»дёӯз”ЁйҖ”е№ҝжіӣзҡ„дёӨз§ҚйҮ‘еұһеҚ•иҙЁпјҢAгҖҒBжҳҜж°§еҢ–зү©пјҢAдёәзәўжЈ•иүІеӣәдҪ“пјҢCгҖҒDгҖҒEжҳҜдёӯеӯҰеёёи§Ғзҡ„дёүз§ҚеҢ–еҗҲзү©гҖӮеҲҶжһҗиҪ¬еҢ–е…ізі»еӣһзӯ”й—®йўҳгҖӮ
пјҲ1пјүиҜ·еҶҷеҮәеҸҚеә”в‘ зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ________________________________гҖӮ пјҲ2пјүз”ұDеҲ°Eзҡ„зҰ»еӯҗж–№зЁӢејҸ_________________________________гҖӮ пјҲ3пјүиӢҘиҜ•еүӮaжҳҜNaOHжә¶ж¶ІпјҢеҶҷеҮәеҚ•иҙЁXдёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүиӢҘиҜ•еүӮbжҳҜH2SO4пјҢе·ҘдёҡдёҠз”ЁEгҖҒH2SO4е’ҢNaNO2дёәеҺҹж–ҷеҲ¶еҸ–й«ҳж•ҲеҮҖж°ҙеүӮY(OH)SO4пјҢе·ІзҹҘиҝҳеҺҹдә§зү©дёәNOпјҢеҲҷиҜҘеҸҚеә” пјҲ5пјүе·ҘдёҡдёҠз”өи§ЈзҶ”иһҚзҡ„BеҲ¶еҸ–Xж—¶пјҢиӢҘйҳіжһҒдә§з”ҹзҡ„ж°”дҪ“еңЁж ҮеҮҶзҠ¶еҶөдёӢзҡ„дҪ“з§Ҝдёә33.6 LпјҢеҲҷйҳҙжһҒдә§зү©зҡ„иҙЁйҮҸдёә______________гҖӮ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺ19.2g CuдёҺиҝҮйҮҸзҡ„50 mL 18 molВ·LпјҚ1жө“зЎ«й…ёеҠ зғӯе®Ңе…ЁеҸҚеә”еҗҺпјҢ еҸҚеә”ж–№зЁӢејҸеҰӮдёӢпјҡ Cu + 2H2SO4пјҲжө“пјү пјҲ1пјүеҫ—еҲ°SO2ж°”дҪ“зҡ„дҪ“з§ҜпјҲж ҮеҮҶзҠ¶еҶөдёӢпјүжҳҜВ В В В В В В В В В В В В В В В В В В В В В Lпјӣ пјҲ2пјүиӢҘеҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…Ҙж°ҙиҮіжә¶ж¶Ізҡ„дҪ“з§Ҝдёә500mLпјҢеҸ–еҮә50mLпјҢйӮЈд№Ҳ50mLжә¶ж¶ІдёӯCuSO4В зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәВ В В В В В В В В В В molВ·L-1пјӣ пјҲ3пјүеҫҖеҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…Ҙи¶ійҮҸзҡ„BaCl2пјҢеҸҜд»Ҙз”ҹжҲҗзЎ«й…ёй’ЎжІүж·ҖдёәВ В В В В В В В В В В В В gгҖӮ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
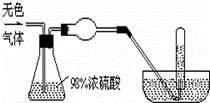
жңүдёҖж— иүІж°”дҪ“пјҲеҸҜиғҪз”ұO2гҖҒN2гҖҒCO2гҖҒHClгҖҒNH3гҖҒH2гҖҒNOгҖҒNO2дёӯзҡ„дёҖз§ҚжҲ–еҮ з§Қз»„жҲҗпјүпјҢдҪ“з§Ҝдёә100mLпјҺеҰӮеӣҫзӨәйҖҡиҝҮжө“зЎ«й…ёзҡ„жҙ—气瓶пјҢеҸ‘зҺ°ж°”дҪ“дҪ“з§ҜеҮҸе°‘еҲ°дёҖеҚҠпјӣйҖҡиҝҮзҗғеҪўе№ІзҮҘз®ЎеҗҺж°”дҪ“е‘ҲзәўжЈ•иүІпјҢеҶҚе°ҶиҜҘж°”дҪ“е®Ңе…ЁйҖҡе…Ҙзӣӣж»Ўж°ҙдё”еҖ’з«ӢдәҺж°ҙж§Ҫзҡ„иҜ•з®ЎеҶ…пјҢеҸ‘зҺ°еҖ’з«ӢдәҺж°ҙж§Ҫзҡ„иҜ•з®ЎеҶ…зҡ„ж°ҙдҪҚдёӢйҷҚеҗҺеҸҲзј“ж…ўдёҠеҚҮпјҢжңҖеҗҺиҜ•з®ЎеҶ…е…ЁйғЁе……ж»Ўж¶ІдҪ“пјҢз”ұжӯӨеҲӨж–ӯпјҡ
пјҲ1пјүзҗғеҪўе№ІзҮҘз®ЎеҶ…зҡ„еӣәдҪ“жҳҜВ В В В В В В В В пјҢеҸҚеә”ж–№зЁӢејҸдёәВ В В В В В В В В В пјӣ пјҲ2пјүеҺҹж°”дҪ“дёӯдёҖе®ҡжңүNH4пјҲ50mlпјүе’ҢВ В В В В В В В В В В В пјҲеЎ«дёӨз§Қж°”дҪ“пјүпјҢе…¶дҪ“з§ҜеҲҶеҲ«жҳҜВ В В В В В В В В В В пјӣеҺҹж°”дҪ“дёӯдёҖе®ҡжІЎжңүВ В В В В В В В В пјҺ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ҙжҳҜдәәзұ»дёҚеҸҜзјәе°‘зҡ„зү©иҙЁгҖӮж—Ҙеёёз”ҹжҙ»дёӯжңүдәәе–ңж¬ўе–қзәҜеҮҖж°ҙпјҢеёӮе”®зәҜеҮҖж°ҙжңүдёҖдәӣжҳҜи’ёйҰҸж°ҙпјҢжңүе…іиҝҷзұ»зәҜеҮҖж°ҙзҡ„иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AгҖҒе®ғжҳҜзәҜеӨ©з„¶йҘ®е“ҒпјҢдёҚеҗ«д»»дҪ•еҢ–еӯҰзү©иҙЁ BгҖҒе®ғеҗ«жңүдәәдҪ“жүҖйңҖзҡ„зҹҝзү©иҙЁе’ҢеӨҡз§Қеҫ®йҮҸе…ғзҙ CгҖҒз”ЁеӮ¬еҢ–еүӮжҠҠе®ғиҪ¬еҸҳжҲҗжұҪжІ№жҳҜ第дә”еӨ§еҸ‘жҳҺ DгҖҒе®ғжё…жҙҒгҖҒзәҜеҮҖпјҢдҪҶй•ҝжңҹйҘ®з”ЁеҜ№еҒҘеә·ж— зӣҠ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺдёӢеҲ—иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜ AпјҺзҰ»еӯҗеҢ–еҗҲзү©дёӯпјҢйҳҙгҖҒйҳізҰ»еӯҗй—ҙеӯҳеңЁйқҷз”өеҗёеј•еҠӣ BпјҺHFгҖҒHClгҖҒHBrе’ҢHIзҡ„зғӯзЁіе®ҡжҖ§е’ҢиҝҳеҺҹжҖ§д»Һе·ҰеҲ°еҸідҫқж¬ЎеҮҸејұ CпјҺ第дёүе‘ЁжңҹйқһйҮ‘еұһе…ғзҙ еҜ№еә”зҡ„еҗ«ж°§й…ёд»Һе·ҰеҲ°еҸідҫқж¬Ўеўһејә DпјҺзҹӯе‘Ёжңҹе…ғзҙ еҪўжҲҗзҰ»еӯҗеҗҺпјҢжңҖеӨ–еұӮз”өеӯҗж•°йғҪиҫҫеҲ°8з”өеӯҗзЁіе®ҡз»“жһ„
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
зҒ«жі•зӮјй“ңзҡ„еҺҹзҗҶдёәпјҡCu2S + O2 й«ҳжё© В 2Cu + SO2пјҢдёӢеҲ—иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜ AпјҺCu2SеҸӘдҪңиҝҳеҺҹеүӮ BпјҺиҜҘеҸҚеә”дёӯзҡ„ж°§еҢ–еүӮеҸӘжңүO2 CпјҺCu2S дёӯзҡ„Cuе…ғзҙ иў«Sе…ғзҙ иҝҳеҺҹ DпјҺеҪ“1 mol O2еҸӮеҠ еҸҚеә”ж—¶пјҢе…ұиҪ¬з§»4 mol e-
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зү©иҙЁдёӯпјҢYж—ўиғҪдёҺXеҸҚеә”еҸҲиғҪдёҺZеҸҚеә”зҡ„жҳҜ
AпјҺв‘ в‘ўВ В В В В В BпјҺв‘ в‘ЈВ В В В В В В В В CпјҺв‘Ўв‘ЈВ В В В В В В В DпјҺв‘Ўв‘ў
|
|||||||||||||||||||||
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
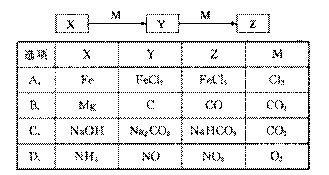
дёӢиЎЁеҗ„з»„зү©иҙЁдёӯпјҢзү©иҙЁд№Ӣй—ҙдёҚеҸҜиғҪе®һзҺ°еҰӮеӣҫжүҖзӨәиҪ¬еҢ–зҡ„жҳҜ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
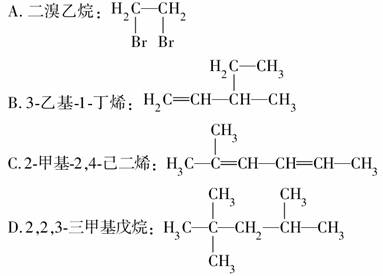
дёӢеҲ—жңүжңәзү©зҡ„е‘ҪеҗҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В (гҖҖгҖҖ)
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҠҪж»Ө瓶еҶ…ж”ҫдёҖе°Ҹеқ—йҮ‘еұһй’ пјҢеҗҢ时收йӣҶж»ЎCO2ж°”дҪ“并еЎһзҙ§з“¶еЎһгҖӮд»ҺеҲҶж¶ІжјҸж–—дёӯж”ҫе…ҘдёҖе®ҡйҮҸзҡ„ж°ҙпјҢеҫ…й’ е®Ңе…ЁеҸҚеә”并жҒўеӨҚеҲ°еҸҚеә”еүҚжё©еәҰж—¶пјҢеҸ‘зҺ°ж°”зҗғеҮ№зҳӘпјҢеҲҷжҠҪж»Ө瓶еҶ…жә¶ж¶Ідёӯзҡ„жә¶иҙЁжҳҜ
AпјҺNaOHдёҺNa2CO3В В В В В В В В В В В В В В BпјҺNa2CO3 CпјҺNa2CO3дёҺNaHCO3В В В В В В В В В В В В DпјҺNaHCO3
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ҹзғ·йә»йҶүдҪңз”ЁжҜ”еҗ—е•Ўејә100еҖҚгҖӮж°ҹзғ·еҢ–еӯҰејҸдёәC2HClBrF3пјҢеҲҷжІёзӮ№дёҚеҗҢзҡ„дёҠиҝ°ж°ҹзғ·жңүВ В В В В В В В В В В В AпјҺ4з§ҚВ В В В В В В В В В BпјҺ3з§ҚВ В В В В В В В В CпјҺ2з§ҚВ В В В В В В В В В DпјҺ1з§Қ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺеҢ–еӯҰдёҺ科еӯҰгҖҒжҠҖжңҜгҖҒзӨҫдјҡгҖҒзҺҜеўғеҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AгҖҒдёҖдәӣзәізұіжқҗж–ҷзҡ„еҲ¶еӨҮпјҢеҶ¶йҮ‘е·Ҙдёҡдёӯзҡ„йҖүзҹҝпјҢзҹіжІ№еҺҹжІ№зҡ„и„ұж°ҙпјҢеЎ‘ж–ҷгҖҒж©Ўиғ¶еҸҠеҗҲжҲҗзәӨз»ҙзӯүзҡ„еҲ¶йҖ иҝҮзЁӢйғҪдјҡз”ЁеҲ°иғ¶дҪ“гҖӮ BгҖҒжӨҚзү©жІ№гҖҒи„ӮиӮӘгҖҒзҹҝзү©жІ№гҖҒдәәйҖ еҘ¶жІ№зҡ„дё»иҰҒжҲҗеҲҶйғҪжҳҜй«ҳзә§и„ӮиӮӘй…ёз”ҳжІ№й…ҜгҖӮ CгҖҒйҰ–е…ҲеңЁе®һйӘҢе®ӨеҲ¶еҫ—йҮ‘еұһй’ зҡ„科еӯҰ家жҳҜжҲҙз»ҙпјҢеҗҢж—¶д»–иҝҳеҲ¶еҫ—дәҶйҮ‘еұһй•ҒгҖӮ DгҖҒж°ўж°”жҳҜ21дё–зәӘжһҒжңүеүҚйҖ”зҡ„ж–°еһӢиғҪжәҗпјҢ科еӯҰ家еҸҜд»ҘеҲ©з”Ёи“қз»ҝи—»зӯүдҪҺзӯүжӨҚзү©е’Ңеҫ®з”ҹзү©еңЁйҳіе…үдҪңз”ЁдёӢдҪҝж°ҙеҲҶи§Јдә§з”ҹж°ўж°”д»ҺиҖҢеҲ©з”Ёж°ўиғҪгҖӮ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұзҹӯе‘Ёжңҹе…ғзҙ жһ„жҲҗзҡ„жҹҗзҰ»еӯҗеҢ–еҗҲзү©дёӯпјҢдёҖдёӘйҳізҰ»еӯҗе’ҢдёҖдёӘйҳҙзҰ»еӯҗж ёеӨ–з”өеӯҗж•°д№Ӣе’Ңдёә20гҖӮдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺжҷ¶дҪ“дёӯйҳізҰ»еӯҗе’ҢйҳҙзҰ»еӯҗзҡ„дёӘж•°дёҚдёҖе®ҡзӣёзӯү BпјҺжҷ¶дҪ“дёӯдёҖе®ҡеҸӘжңүзҰ»еӯҗй”®жІЎжңүе…ұд»·й”® CпјҺжүҖеҗ«е…ғзҙ дёҖе®ҡдёҚеңЁеҗҢдёҖе‘Ёжңҹд№ҹдёҚеңЁз¬¬дёҖе‘Ёжңҹ DпјҺжҷ¶дҪ“дёӯйҳізҰ»еӯҗеҚҠеҫ„дёҖе®ҡеӨ§дәҺйҳҙзҰ»еӯҗеҚҠеҫ„
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
N2Oдҝ—з§°вҖң笑气вҖқпјҢжӣҫз”ЁдҪңеҸҜеҗёе…ҘжҖ§йә»йҶүеүӮпјҢдә§з”ҹN2OеҸҚеә”пјҡ3CO+2NO2в•җ3CO2+N2OпјҺдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺеҸҚеә”дёӯжҜҸз”ҹжҲҗl mol N2OпјҢиҪ¬з§»4molз”өеӯҗ BпјҺN2OеҸӘжңүж°§еҢ–жҖ§пјҢж— иҝҳеҺҹжҖ§ CпјҺN2Oе’ҢCO2дә’дёәзӯүз”өеӯҗдҪ“ DпјҺNO2еұһдәҺй…ёжҖ§ж°§еҢ–зү©
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
зӯүиҙЁйҮҸзҡ„O2е’ҢO3дёӯ AпјҺжүҖеҗ«еҺҹеӯҗж•°зӣёеҗҢ BпјҺжүҖеҗ«еҲҶеӯҗж•°зӣёеҗҢВ CпјҺеҗҢжё©еҗҢеҺӢдёӢпјҢж°”дҪ“дҪ“з§ҜзӣёеҗҢ DпјҺеҗҢжё©еҗҢеҺӢдёӢпјҢж°”дҪ“зҡ„еҜҶеәҰзӣёеҗҢ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„ж¶ІдҪ“ж··еҗҲзү©пјҢеҸҜд»Ҙз”ЁеҲҶж¶ІжјҸж–—еҲҶзҰ»зҡ„жҳҜ AгҖҒд№ҷйҶҮе’Ңж°ҙВ В В В В В В В В В В В В В В В В В В В BгҖҒжәҙд№ҷзғ·е’Ңж°ҙ CгҖҒжәҙд№ҷзғ·е’Ңж°Ҝд»ҝВ В В В В В В В В В В В В В В В DгҖҒиӢҜе’ҢжәҙиӢҜ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ | ||
|
в‘ҙз”Ё18mol/Lжө“зЎ«й…ёй…ҚеҲ¶100mL 1.0mol/Lзҡ„зЁҖзЎ«й…ёпјҢиӢҘе®һйӘҢд»ӘеҷЁжңүпјҡ AпјҺ100mLйҮҸзӯ’В BпјҺзҺ»з’ғжЈ’гҖҖ В В CпјҺжүҳзӣҳеӨ©е№ігҖҖ DпјҺ50mLе®№йҮҸ瓶 EпјҺ10mLйҮҸзӯ’гҖҖ FпјҺиғ¶еӨҙж»ҙз®ЎгҖҖ GпјҺ50mLзғ§жқҜгҖҖ HпјҺ100mLе®№йҮҸ瓶 е®һйӘҢж—¶еҝ…йЎ»йҖүз”Ёзҡ„д»ӘеҷЁжҳҜпјҲеЎ«е…Ҙеӯ—жҜҚпјүВ В В В В В В В В В В В В В В 20090204 AпјҺдҪҝз”Ёе®№йҮҸ瓶еүҚйңҖжЈҖжҹҘе®ғжҳҜеҗҰжјҸж°ҙ BпјҺе®№йҮҸ瓶用蒸йҰҸж°ҙжҙ—еҮҖеҗҺпјҢдёҖе®ҡиҰҒе№ІзҮҘеҗҺеҶҚдҪҝз”Ё CпјҺй…ҚеҲ¶жә¶ж¶Іж—¶пјҢз”ЁйҮҸзӯ’йҮҸеҸ–иҜ•ж ·еҗҺзӣҙжҺҘеҖ’е…Ҙе®№йҮҸ瓶дёӯпјҢзј“ж…ўеҠ е…Ҙи’ёйҰҸж°ҙиҮіеҲ»еәҰзәҝ DпјҺе®ҡе®№еҗҺзӣ–еҘҪ瓶еЎһпјҢеҸҚеӨҚдёҠдёӢйў еҖ’пјҢж‘ҮеҢҖ ⑶иӢҘе®һйӘҢж—¶йҒҮеҲ°дёӢеҲ—жғ…еҶөпјҢе°ҶдҪҝжүҖй…Қжә¶ж¶Ізҡ„жө“еәҰ В В В В В В В В пјҲеЎ«вҖңеҒҸй«ҳвҖқгҖҒвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқпјү AпјҺе®ҡе®№ж—¶дҝҜи§ҶиҜ»ж•°В В В В В В В В В В BпјҺжңӘе°Ҷжҙ—ж¶Өж¶ІиҪ¬е…Ҙе®№йҮҸ瓶         CпјҺжҙ—ж¶ӨйҮҸзӯ’пјҢ并е°Ҷжҙ—ж¶Өж¶ІиҪ¬е…Ҙе®№йҮҸ瓶       В
|
|||
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
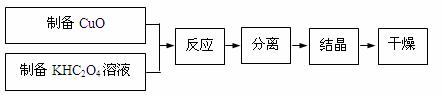
дәҢиҚүй…ёеҗҲй“ңпјҲв…Ўпјүй…ёй’ҫжҷ¶дҪ“{K2[CuпјҲC2O4пјү2]В·2H2O}еҲ¶еӨҮжөҒзЁӢеҰӮдёӢпјҡ
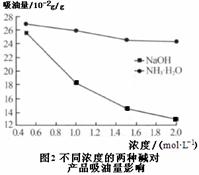
пјҲе·ІзҹҘпјҡH2C2O4 пјҲ1пјүеҲ¶еӨҮCuOпјҡCuSO4жә¶ж¶Ідёӯж»ҙе…ҘNaOHжә¶ж¶ІпјҢеҠ зғӯз…®жІёгҖҒеҶ·еҚҙгҖҒеҸҢеұӮж»ӨзәёиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖӮ в‘ з”ЁеҸҢеұӮж»ӨзәёиҝҮж»Өзҡ„еҺҹеӣ жҳҜВ В В В В гҖӮ в‘Ўз”Ёи’ёйҰҸж°ҙжҙ—ж¶Өж°§еҢ–й“ңж—¶пјҢеҰӮдҪ•иҜҒжҳҺж°§еҢ–й“ңе·Іжҙ—ж¶Өе№ІеҮҖВ В В В В гҖӮ пјҲ2пјүдёәдәҶжҸҗй«ҳCuOзҡ„еҲ©з”ЁзҺҮпјҢеҰӮдҪ•и®©CuOе……еҲҶиҪ¬з§»еҲ°зғӯзҡ„KHC2O4жә¶ж¶ІдёӯВ В В В пјӣ50в„ғж°ҙжөҙеҠ зғӯиҮіеҸҚеә”е……еҲҶпјҢеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В пјӣеҶҚз»Ҹи¶ҒзғӯиҝҮж»ӨгҖҒжІёж°ҙжҙ—ж¶ӨгҖҒе°Ҷж»Өж¶Іи’ёеҸ‘жө“зј©еҫ—еҲ°дәҢиҚүй…ёеҗҲй“ңпјҲв…Ўпјүй…ёй’ҫжҷ¶дҪ“гҖӮ пјҲ3пјүжң¬е®һйӘҢз”ЁK2CO3зІүжң«дёҺиҚүй…ёжә¶ж¶ІеҸҚеә”еҲ¶еӨҮKHC2O4пјҢиҖҢдёҚз”ЁKOHзІүжң«д»ЈжӣҝK2CO3зІүжң«пјҢе…¶дё»иҰҒеҺҹеӣ жҳҜВ В В В гҖӮ пјҲ4пјүдәҢиҚүй…ёеҗҲй“ңпјҲв…Ўпјүй…ёй’ҫжҷ¶дҪ“зҡ„еҲ¶еӨҮд№ҹеҸҜд»Ҙз”ЁCuSO4жҷ¶дҪ“е’ҢK2C2O4жә¶ж¶ІеҸҚеә”еҫ—еҲ°гҖӮд»ҺзЎ«й…ёй“ңжә¶ж¶ІдёӯиҺ·еҫ—зЎ«й…ёй“ңжҷ¶дҪ“зҡ„е®һйӘҢжӯҘйӘӨдёәпјҡеҠ е…ҘйҖӮйҮҸд№ҷйҶҮгҖҒи’ёеҸ‘жө“зј©гҖҒеҶ·еҚҙз»“жҷ¶гҖҒиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘгҖӮв‘ еҠ е…ҘйҖӮйҮҸд№ҷйҶҮзҡ„дјҳзӮ№жңүпјҡ aпјҺзј©зҹӯеҠ зғӯзҡ„ж—¶й—ҙпјҢйҷҚдҪҺиғҪиҖ—пјӣ bпјҺВ В В В гҖӮ в‘ЎеңЁи’ёеҸ‘жө“зј©зҡ„еҲқе§Ӣйҳ¶ж®өиҝҳйҮҮз”ЁдәҶеҰӮеӣҫжүҖзӨәзҡ„иЈ…зҪ®пјҢе…¶зӣ®зҡ„жҳҜВ В В В гҖӮ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
Fe2O3дҝ—з§°ж°§еҢ–й“ҒзәўпјҢеёёз”ЁдҪңжІ№жјҶзқҖиүІеүӮгҖӮе·Ҙдёҡд»Ҙз…ӨзҹёзҹіпјҲдё»иҰҒжҲҗеҲҶпјҡSiO2 49.5%пјӣFe2O3 20.6%пјӣAl2O318.9%пјҢд»ҘеҸҠMgOгҖҒFeOзӯүе…¶д»–жқӮиҙЁпјүеҲ¶еӨҮе№¶з ”з©¶ж°§еҢ–й“Ғзәўзҡ„еә”з”ЁгҖӮ пјҲдёҖпјүеҲ¶еӨҮж°§еҢ–й“Ғзәў 1пјҺйў„еӨ„зҗҶпјҡе°Ҷз…ӨзҹёзҹізІүзўҺпјҢеңЁ350в„ғдёӢз„ҷзғ§2е°Ҹж—¶гҖӮ 2пјҺеҠ й…ёжә¶и§Јпјҡе°Ҷйў„еӨ„зҗҶеҗҺзҡ„з…Өзҹёзҹіжә¶дәҺиҙЁйҮҸеҲҶж•°дёә15%иҝҮйҮҸзҡ„зЎ«й…ёжә¶ж¶ІдёӯпјҢиҝҮж»ӨгҖӮеңЁж»Өж¶ІдёӯеҠ е…Ҙзҡ„H2O2гҖӮ 3пјҺи°ғиҠӮpHпјҡеңЁдёҠиҝ°ж»Өж¶ІдёӯеҠ 1mol/LNaOHжә¶ж¶Іи°ғиҠӮжә¶ж¶Ізҡ„pHпјҢеҶҚиҝҮж»ӨпјҢеҫ—еҲ°ж»ӨжёЈгҖӮ 4пјҺдә§е“ҒеӨ„зҗҶпјҡе°Ҷж»ӨжёЈиҝӣиЎҢж°ҙжҙ—гҖҒзғҳе№ІгҖҒз……зғ§гҖҒз ”зЈЁгҖҒиҝҮзӯӣеҫ—дә§е“ҒгҖӮ е·ІзҹҘйғЁеҲҶйҳізҰ»еӯҗд»Ҙж°ўж°§еҢ–зү©еҪўејҸжІүж·Җж—¶жә¶ж¶Ізҡ„pHи§ҒдёӢиЎЁ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүйў„еӨ„зҗҶж—¶пјҢе°Ҷз…Өзҹёзҹіз„ҷзғ§2е°Ҹж—¶зҡ„зӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүй…ёжөёж“ҚдҪңдёӯпјҢиҝҮйҮҸH2SO4зҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ еңЁе®һйӘҢе®ӨдёӯиҝӣиЎҢиҜҘж“ҚдҪңж—¶пјҢз”ЁеҲ°зҺ»з’ғд»ӘеҷЁжңүВ В В В В В гҖҒВ В В В В гҖӮ пјҲ3пјүз”ЁNaOHжә¶ж¶Іи°ғиҠӮpHзҡ„жңҖдҪіиҢғеӣҙжҳҜВ В В В В В гҖӮиӢҘд»Һ第дәҢж¬ЎиҝҮж»Өзҡ„ж»Өж¶ІдёӯиҺ·еҸ–иҫғзәҜеҮҖзҡ„зЎ«й…ёй•Ғжҷ¶дҪ“пјҢеә”иЎҘе……зҡ„ж“ҚдҪңжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В гҖҒжҙ—ж¶ӨеҗҺпјҢе№ІзҮҘеҚіеҫ—гҖӮ пјҲ4пјүдә§е“ҒеӨ„зҗҶж—¶пјҢеҜ№ж»ӨжёЈж°ҙжҙ—зҡ„ж“ҚдҪңжҳҜ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲдәҢпјүеҲҶжһҗдёҺи®Ёи®әпјҡ
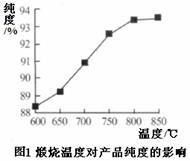
пјҲ5пјүдә§е“ҒеӨ„зҗҶж—¶пјҢз……зғ§жё©еәҰеҜ№дә§е“Ғзҡ„зәҜеәҰжңүеҫҲеӨ§еҪұе“ҚгҖӮе·ІзҹҘжё©еәҰеҜ№дә§зү©зәҜеәҰзҡ„еҪұе“ҚеҰӮеӣҫ1жүҖзӨәпјҢеҲҷз……зғ§ж—¶жё©еәҰжңҖеҘҪжҺ§еҲ¶еңЁВ В В В В в„ғгҖӮ пјҲ6пјүеҗёжІ№йҮҸжҳҜеҸҚжҳ ж°§еҢ–й“ҒзәўиЎЁйқўжҖ§иҙЁзҡ„йҮҚиҰҒжҢҮж ҮгҖӮеҗёжІ№йҮҸеӨ§пјҢиҜҙжҳҺж°§еҢ–й“ҒзәўиЎЁйқўз§ҜиҫғеӨ§пјҢеҲҷз”ЁеңЁжІ№жјҶдёӯдјҡйҖ жҲҗжІ№жјҶеҒҮзЁ пјҢеҪұе“ҚиҙЁйҮҸгҖӮдёҚеҗҢжө“еәҰзҡ„дёӨз§Қзўұжә¶ж¶ІеҜ№дә§зү©еҗёжІ№йҮҸеҪұе“ҚеҰӮеӣҫ2жүҖзӨәпјҢеҲҷдёҠиҝ°з”ҹдә§дёӯеңЁи°ғиҠӮжә¶ж¶ІpHж—¶пјҢйҖүз”ЁNaOHжә¶ж¶ІиҖҢдёҚйҖүз”Ёж°Ёж°ҙзҡ„еҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
||||||||||||||||
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
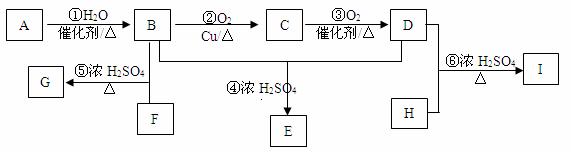
пјҺжҹҗж°”жҖҒзғғAдёҺH2зҡ„зӣёеҜ№еҜҶеәҰдёә14пјҢе…¶дә§йҮҸеҸҜд»Ҙз”ЁжқҘиЎЎйҮҸдёҖдёӘеӣҪ家зҡ„зҹіжІ№еҢ–е·ҘеҸ‘еұ•ж°ҙе№ігҖӮд»ҘиҜҘеҢ–еҗҲзү©дёәеҺҹж–ҷеҗҲжҲҗеҢ–еҗҲзү©GгҖҒEе’ҢIзҡ„жөҒзЁӢеҰӮдёӢпјҡ е·ІзҹҘпјҡв… пјҺиҠійҰҷж—ҸеҢ–еҗҲзү©FдёәCгҖҒHгҖҒOеҢ–еҗҲзү©пјҢе…¶зӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә166пјҢзҺҜдёҠзҡ„дёҖж°Ҝд»Јзү©жңүдёҖз§ҚпјҢ1 mol FдёҺи¶ійҮҸNaHCO3жә¶ж¶ІеҸҚеә”иғҪз”ҹжҲҗ2 mol CO2пјҢFдёҺи¶ійҮҸBеҸҚеә”з”ҹжҲҗGгҖӮ в…ЎпјҺHдёәдәҢе…ғйҶҮпјҢе…¶и’ёж°”еҜҶеәҰжҠҳз®—жҲҗж ҮеҮҶзҠ¶еҶөдёә2.77 g/LпјҢHдёҺи¶ійҮҸDеҸҚеә”з”ҹжҲҗIгҖӮ
пјҲ1пјүA гҖҒDеҲҶеӯҗжүҖеҗ«зҡ„е®ҳиғҪеӣўзҡ„еҗҚз§°дҫқж¬ЎжҳҜВ В В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В В В гҖӮ пјҲ2пјүBеҸҜд»ҘеҸ‘з”ҹзҡ„еҸҚеә”жңүВ В В В В В В В В В пјҲйҖүеЎ«еәҸеҸ·пјүгҖӮ в‘ еҸ–д»ЈеҸҚеә”В В В в‘Ўж¶ҲеҺ»еҸҚеә”В В В в‘ўеҠ иҒҡеҸҚеә”В В В в‘Јж°§еҢ–еҸҚеә” пјҲ3пјүеҸҚеә”в‘Өзҡ„еҸҚеә”зұ»еһӢдёәВ В В В В В В В В В В В В В В гҖӮ пјҲ4пјүFдёҺHеҸҜз”ҹжҲҗй«ҳеҲҶеӯҗеҢ–еҗҲзү©JпјҢеҶҷеҮәз”ҹжҲҗJзҡ„еҢ–еӯҰеҸҚеә”ж–№зЁӢејҸпјҡВ В В В В В В В В В ,Jзҡ„еҗҚз§°жҳҜВ В В В В В В В В В В В В В В гҖӮ пјҲ5пјүеҶҷеҮәдёӢеҲ—еҢ–еӯҰж–№зЁӢејҸпјҡ в‘ЎВ В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ҘВ В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ пјҲ6пјү жҹҗеӯҰз”ҹз”Ёж–°еҲ¶зҡ„Cu(OH)2жЈҖйӘҢCзҡ„е®ҳиғҪеӣўпјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В пјҢиҜҘеӯҰз”ҹеҸ–1mol/LCuSO4жә¶ж¶Іе’Ң1mol/LNaOHжә¶ж¶Іеҗ„1mLпјҢеңЁдёҖж”ҜжҙҒеҮҖзҡ„иҜ•з®ЎеҶ…ж··еҗҲеҗҺпјҢеҗ‘е…¶дёӯеҸҲеҠ е…Ҙ0.5mL40%зҡ„CпјҢеҠ зғӯеҗҺж— зәўиүІжІүж·ҖеҮәзҺ°гҖӮиҜҘеҗҢеӯҰе®һйӘҢеӨұиҙҘзҡ„еҺҹеӣ еҸҜиғҪжҳҜВ В В В В В В В В гҖӮпјҲйҖүеЎ«еәҸеҸ·пјү в‘ еҠ е…Ҙзҡ„CиҝҮеӨҡВ В В В В В В В В В В В В В В В В в‘Ў еҠ е…Ҙзҡ„CеӨӘе°‘ в‘ў еҠ е…ҘCuSO4жә¶ж¶Ізҡ„йҮҸиҝҮеӨҡВ В В В В В В в‘Ј еҠ е…ҘCuSO4жә¶ж¶Ізҡ„йҮҸдёҚеӨҹ пјҲ7пјүIжңүеӨҡз§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢе…¶дёӯдёҖзұ»еҗҢеҲҶејӮжһ„дҪ“жңүеҰӮдёӢзү№еҫҒпјҡ в‘ еҲҶеӯҗдёӯеҗ«жңүдә”е…ғзҺҜз»“жһ„пјӣв‘Ў1 molиҜҘжңүжңәзү©дёҺи¶ійҮҸNaHCO3жә¶ж¶ІеҸҚеә”пјҢиғҪз”ҹжҲҗ1 mol CO2пјӣв‘ў1 molиҜҘжңүжңәзү©дёҺи¶ійҮҸNaеҸҚеә”пјҢиғҪз”ҹжҲҗ1.5 mol H2пјӣв‘ЈзҺҜдёҠзҡ„дёҖж°Ҝд»Јзү©еҸӘжңүдёүз§ҚгҖӮеҲҷж»Ўи¶ід»ҘдёҠжқЎд»¶зҡ„дёӨз§Қжңүжңәзү©зҡ„з»“жһ„з®ҖејҸдёәпјҡВ В В В В В В В В В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В В В В В В В В В
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
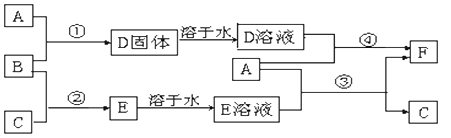
AжҳҜз”ЁйҖ”жңҖе№ҝзҡ„йҮ‘еұһпјҢBгҖҒCжҳҜдёӨз§Қеёёи§Ғж°”дҪ“еҚ•иҙЁпјҢEжә¶ж¶Ідёәеёёи§Ғејәй…ёпјҢDжә¶ж¶Ідёӯж»ҙеҠ KSCNжә¶ж¶ІжҳҫзәўиүІпјҢе®ғ们зӣёдә’иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨәпјҺ
иҜ·еӣһзӯ”пјҡ пјҲ1пјүеҶҷеҮәBзү©иҙЁзҡ„еҢ–еӯҰејҸпјҡВ В В В В В В В В В В В В В В пјҺ пјҲ2пјүеҶҷеҮә第③жӯҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В пјҺ пјҲ3пјү第④жӯҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҺ пјҲ4пјүеҶҷеҮәSO2еңЁж°ҙдёӯдёҺBеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В пјҺ пјҲ5пјүFжә¶ж¶Ідёӯж»ҙе…ҘNaOHжә¶ж¶ІеҸҜиғҪдә§з”ҹзҡ„е®һйӘҢзҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В пјҺ
|
|
- 2019-2020е№ҙй«ҳдёҖеҗҺеҚҠжңҹ第дёҖж¬Ўж®өиҖғеҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲпјҲжІіеҚ—зңҒй№ӨеЈҒеёӮй«ҳдёӯпјү
- й«ҳдәҢдёӢеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲ2019-2020е№ҙиҫҪе®ҒзңҒжІҲйҳіеёӮйғҠиҒ”дҪ“пјү
- е’ёйҳіеёӮ2019е№ҙй«ҳдәҢеүҚеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•зҪ‘дёҠиҖғиҜ•з»ғд№
- дёҠжө·2018е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҶҢиҜҫж—¶з»ғд№ еңЁзәҝе…Қиҙ№иҖғиҜ•
- е®үеҫҪзңҒеҗҚж Ў2020еұҠй«ҳдёүеҶІеҲәжЁЎжӢҹеҚ·зҗҶз»јеҢ–еӯҰиҖғиҜ•
- е…ЁеӣҪй«ҳдёҖеҢ–еӯҰиҜҫж—¶з»ғд№ пјҲ2019е№ҙдёҠжңҹпјүзҪ‘дёҠеңЁзәҝеҒҡйўҳ
- е®үеҫҪзңҒйҳңйҳіеёӮ2021еұҠй«ҳдёүдёҠжңҹж•ҷеӯҰиҙЁйҮҸз»ҹжөӢзҗҶз»јеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- 2019-2020е№ҙй«ҳдәҢеүҚеҚҠжңҹ第еӣӣж¬ЎжңҲиҖғеҢ–еӯҰпјҲе®үеҫҪзңҒеӨӘе’ҢдёӯеӯҰпјү