2016河南高三下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列各组中的离子,能在溶液中大量共存的有( ) A.Na+、H+、CO32-、Cl- B.Mg2+、Al3+、NO3-、OH- C.K+、 H+、SO42-、OH- D.Al3+、Fe2+、Cl、SO42
|
|
| 2. | 详细信息 |
|
向50毫升18摩/升的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( ) A.小于0.45摩 B.等于0.45摩 C.在0.45摩与0.90摩之间 D.大于0.90摩
|
|
| 3. | 详细信息 | ||||||||||
|
实验室里有4个药品橱,已经存放以下物品:
实验室新购进一些碘,应该将这些碘放在 A.甲橱 B.乙橱 C.丙橱 D.丁橱
|
|||||||||||
| 4. | 详细信息 |
|
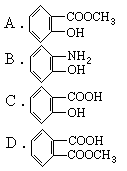
某有机物溶解于NaOH溶液中(滴有酚酞),开始溶液呈红色,煮沸5分钟后,溶液褪色,加入盐酸至酸性时,沉淀出白色的结晶,该结晶溶于水加入FeCl3溶液呈紫色,该有机物可能是
|
|
| 5. | 详细信息 |
|
铸造硬币所用合金的实际价值比其面值 A.高 B.低 C.相等 D.高或相等
|
|
| 6. | 详细信息 |
|
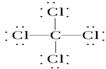
下列表示物质结构的化学用语或模型图正确的是 A.H2O2的电子式: B.CS2的比例模型: C.14C的原子结构示意图: D.CCl4的结构式:
|
|
| 7. | 详细信息 |
|
下列表示对应化学反应的离子方程式正确的是 A.NO2通入水中:3NO2+H2O=2H++2NO3-+NO B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+ D.过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O =Al(OH)3↓+CO32-
|
|
| 8. | 详细信息 |
|
25℃时,水的电离达到平衡:H2O A.向水中加入固体CH3COONa,平衡正向移动,c(H+)降低 B.向水中加入少量固体硫酸氢钠,c(H+)降低,Kw不变 C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 D.将水加热,Kw增大,pH不变
|
|
| 9. | 详细信息 |
|
在pH =0的溶液中,能大量共存的离子组是( ) A.Fe2+、Na+、Cl-、NO-3 B.K+、Ca2+、CH3COO-、HCO-3 C.Na+、Mg2+、NO-3、SO2-4 D.Ba2+、K+、Cl-、SO2-4
|
|
| 10. | 详细信息 |
|
下列说法正确的是 ① 胶体产生丁达尔效应是由胶粒大小决定的 ② 胶体与溶液的分离可用渗析的方法 ③ 胶体都是均匀、透明的液体 ④ 将饱和FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体即为氢氧化铁胶体 ⑤ 胶体不稳定,静置后容易产生沉淀 ⑥ 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 A.①②③④ B. ①②④⑥ C. ①③④⑥ D. ②③④⑤
|
|
| 11. | 详细信息 |
|
下列含有共价键的化合物是( )。 A.HI B.NaOH C.Br2 D.NaCl
|
|
| 12. | 详细信息 |
|
以下做法达不到目的的是 A.蚊虫叮咬时,会释放一种酸性物质,在叮咬处抹些肥皂水(弱碱性),可减轻痛痒症状 B.多吃海带,可预防因缺碘引起的甲状腺肿大 C.将碗、筷高温蒸煮,可杀菌消毒 D.对生活中的塑料垃圾进行填埋,可防止“白色污染”
|
|
| 13. | 详细信息 |
|
设NA表示阿伏加德罗常数,下列说法错误的是( ) A.一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA B.1 L 1 mol/L的FeCl3溶液中含有NA个Fe3+ C.常温常压下,等质量的SO2、S2含有相同的分子数 D.125 g CuSO4·5H2O晶体中含有0.5NA个Cu2+
|
|
| 14. | 详细信息 |
|
下列混合物可以用分液漏斗分离的是 A. 溴乙烷和水 B. 乙醇和苯 C. 乙醇和水 D. 溴苯和苯
|
|
| 15. | 详细信息 |
|
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时, a:b不可能为 A.3:4 B.4:5 C.2:3 D.3:2
|
|
| 16. | 详细信息 |
|
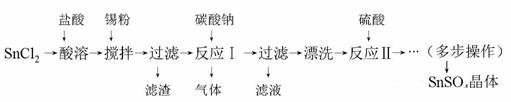
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:
查阅资料: Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。 Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。 请回答下列问题: (1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。 (2)加入Sn粉的作用有两个:①调节溶液pH ② 。 (3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。 (4)多步操作包含的具体实验步骤的名称可以是: 。 (5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。 (6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应): ①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑; ②加入过量的FeCl3 ; ③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O 取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
|
|
| 17. | 详细信息 |
|
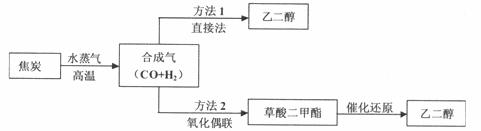
以煤为主要原料可以制备乙二醇,相关工艺流程如下:
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式 (2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是 (填字母)。 A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2] (3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知: CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol 2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol 2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol 则CH4与CO2生成合成气的热化学方程式为 。 (4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应: CH3OOC—COOCH3(g)+ 4H2(g) 为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。 A.升高温度 B.增大压强 C.增大氢气浓度 (5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O ①草酸是二元弱酸,可以制备 ②在一定的 A. B. C. (6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的 (填“正”或“负”)级,负极反应式为 。
|
|
| 18. | 详细信息 |
|
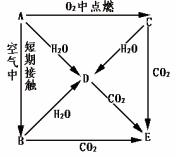
A、B、C、D、E五种物质都含1—18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质。
(1)写出下列物质的化学式: A_______ D________ E________ (2)写出实现下列转化的离子方程式 A→D____________________ C→D____________________
|
|
| 19. | 详细信息 |
|
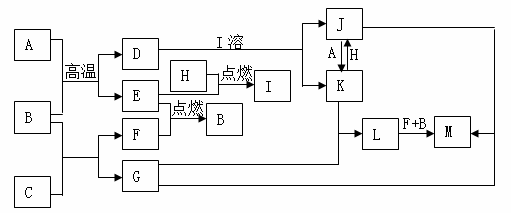
下列框图题中,已知A、E、F、H是单质,其中只有A是一种常见的金属单质,其它都是气体,且H是呈黄绿色;B是最常见液体,C是一种淡黄色粉末,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。
回答下列问题: (1)写出C化学式: ,I的电子式 ; (2)写出离子方程式:K+H: ; (3)写出化学方程式:①B+C: ;
|
|
| 20. | 详细信息 |
|
现有反应:mA(g)+nB(g) (1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。 (2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同) (3)若容积不变加入B,则A的转化率__________,B的转化率__________。 (4)若升高温度,则平衡时B、C的浓度之比将__________。 (5)若加入催化剂,平衡时气体混合物的总物质的量__________。 (6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色 。(填“变深”、“变浅”或“不变”)
|
|
| 21. | 详细信息 |
|
为了探究乙醇和金属钠反应的原理,做了如下四个实验: 实验一:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体。 实验二:设法检验实验一收集到的气体。 实验三:向试管中加入3 mL水,并加入一小块金属钠,观察现象。 实验四:向试管中加入3 mL乙醚(CH3CH2OCH2CH3),并加入一小块金属钠,发现无任何现象发生。 回答以下问题: (1)简述实验二中检验气体的实验方法及作出判断的依据: _____________________________________________________。 (2)从结构上分析,该实验选取水和乙醚做参照物的原因是 _____________________________________________________。 (3)实验三的目的是欲证明__________;实验四的目的是欲证明____________;根据实验三和实验四的结果,可以证明乙醇和金属钠反应的化学方程式应为________________________。
|
|
| 22. | 详细信息 |
|
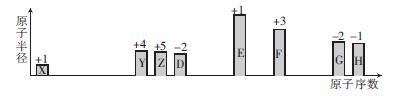
随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价如图所示。
(1)元素Z位于元素周期表的第__________周期___________族,X与Z可形成18电子的化合物,该化合物的电子式为_______________。 (2)非金属性:Y___________(填“>”“<”或“=”)D。 (3)单质F与EDX溶液反应的化学化学方程式为____________________。 (4)G和H可形成一种化合物,其相对分子质量在90~110之间。且G的质量分数约为31.1%,该化合物的化学式为_________。
|
|
| 23. | 详细信息 |
|
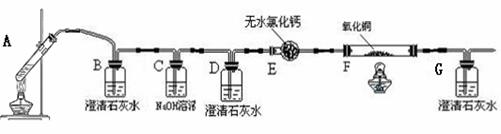
某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO(图中夹持装置已略去)。(已知草酸钙难溶于水,草酸沸点150℃)
(1)装置C的作用是______________________,装置E的作用是 _____________________ (2)乙二酸受热分解的反应方程式是 (3)①证明分解产物中有CO2的现象是 ②证明分解产物中有CO的现象是 (4)该装置有不足之处,请写出弥补不足之处的理由和具体方法:
|
|
| 24. | 详细信息 |
|
将0℃、101KPa条件下的HCl气体44.8L,通入500ml水中(已知水的密度为:1.00g/ml),得到密度为1.13g/ml的盐酸(即氯化氢的水溶液)。 (1)求此盐酸中溶质的物质的量浓度? (计算结果保留一位小数) (2)在此盐酸中加入250ml氢氧化钡溶液恰好完全反应,计算氢氧化钡溶液中OH-的物质的量浓度?
|
|