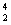2021жІіеҢ—й«ҳдёӯеҢ–еӯҰй«ҳиҖғзңҹйўҳ
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
вҖң зҒҢй’ўжі• вҖқ жҳҜжҲ‘еӣҪеҸӨд»ЈеҠіеҠЁдәәж°‘еҜ№й’ўй“ҒеҶ¶зӮјжҠҖжңҜзҡ„йҮҚеӨ§иҙЎзҢ®пјҢйҷ¶ејҳжҷҜеңЁе…¶гҖҠжң¬иҚүз»ҸйӣҶжіЁгҖӢдёӯжҸҗеҲ° вҖң й’ўй“ҒжҳҜжқӮзӮјз”ҹйҚ’дҪңеҲҖй•°иҖ… вҖқ гҖӮ вҖң зҒҢй’ўжі• вҖқ дё»иҰҒжҳҜе°Ҷз”ҹй“Ғе’ҢзҶҹй“Ғ ( еҗ«зўійҮҸзәҰ 0.1%) ж··еҗҲеҠ зғӯпјҢз”ҹй“ҒзҶ”еҢ–зҒҢе…ҘзҶҹй“ҒпјҢеҶҚй”»жү“жҲҗй’ўгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ й’ўжҳҜд»Ҙй“Ғдёәдё»зҡ„еҗ«зўіеҗҲйҮ‘ B пјҺ й’ўзҡ„еҗ«зўійҮҸи¶Ҡй«ҳпјҢзЎ¬еәҰе’Ңи„ҶжҖ§и¶ҠеӨ§ C пјҺ з”ҹй“Ғз”ұдәҺеҗ«зўійҮҸй«ҳпјҢзҶ”зӮ№жҜ”зҶҹй“Ғй«ҳ D пјҺ еҶ¶зӮјй“Ғзҡ„еҺҹж–ҷд№ӢдёҖиөӨй“Ғзҹҝзҡ„дё»иҰҒжҲҗеҲҶдёә Fe 2 O 3 |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
й«ҳеҲҶеӯҗжқҗж–ҷеңЁз”ҹдә§з”ҹжҙ»дёӯеә”з”Ёе№ҝжіӣгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ иҠҰиӢҮеҸҜз”ЁдәҺеҲ¶йҖ й»Ҹиғ¶зәӨз»ҙпјҢе…¶дё»иҰҒжҲҗеҲҶдёәзәӨз»ҙзҙ B пјҺ иҒҡж°Ҝд№ҷзғҜйҖҡиҝҮеҠ иҒҡеҸҚеә”еҲ¶еҫ—пјҢеҸҜз”ЁдәҺеҲ¶дҪңдёҚзІҳй”…зҡ„иҖҗзғӯж¶ӮеұӮ C пјҺ ж·ҖзІүжҳҜзӣёеҜ№еҲҶеӯҗиҙЁйҮҸеҸҜиҫҫеҮ еҚҒдёҮзҡ„еӨ©з„¶й«ҳеҲҶеӯҗзү©иҙЁ D пјҺ еӨ§иұҶиӣӢзҷҪзәӨз»ҙжҳҜдёҖз§ҚеҸҜйҷҚи§Јжқҗж–ҷ |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
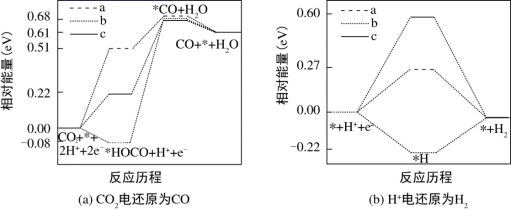
дёӢеҲ—ж“ҚдҪң规иҢғдё”иғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜ A пјҺ еӣҫз”ІжөӢе®ҡйҶӢй…ёжө“еәҰ B пјҺ еӣҫд№ҷжөӢе®ҡдёӯе’Ңзғӯ C пјҺ еӣҫдёҷзЁҖйҮҠжө“зЎ«й…ё D пјҺ еӣҫдёҒиҗғеҸ–еҲҶзҰ»зўҳж°ҙдёӯзҡ„зўҳ |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ«е’Ңж°®еҸҠе…¶еҢ–еҗҲзү©еҜ№дәәзұ»з”ҹеӯҳе’ҢзӨҫдјҡеҸ‘еұ•ж„Ҹд№үйҮҚеӨ§пјҢдҪҶзЎ«ж°§еҢ–зү©е’Ңж°®ж°§еҢ–зү©йҖ жҲҗзҡ„зҺҜеўғй—®йўҳд№ҹж—ҘзӣҠеҸ—еҲ°е…іжіЁпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A пјҺ NO 2 е’Ң SO 2 еқҮдёәзәўжЈ•иүІдё”жңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“пјҢжҳҜй…ёйӣЁзҡ„дё»иҰҒжҲҗеӣ B пјҺ жұҪиҪҰе°ҫж°”дёӯзҡ„дё»иҰҒеӨ§ж°”жұЎжҹ“зү©дёә NO гҖҒ SO 2 е’Ң PM2.5 C пјҺ жӨҚзү©зӣҙжҺҘеҗёж”¶еҲ©з”Ёз©әж°”дёӯзҡ„ NO е’Ң NO 2 дҪңдёәиӮҘж–ҷпјҢе®һзҺ°ж°®зҡ„еӣәе®ҡ D пјҺ е·Ҙдёҡеәҹж°”дёӯзҡ„ SO 2 еҸҜйҮҮз”ЁзҹізҒ°жі•иҝӣиЎҢи„ұйҷӨ |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁдёӯеӯҗиҪ°еҮ» A пјҺ H 3 XO 3 еҸҜз”ЁдәҺдёӯе’Ңжә…еңЁзҡ®иӮӨдёҠзҡ„ NaOH жә¶ж¶І B пјҺ Y еҚ•иҙЁеңЁз©әж°”дёӯзҮғзғ§зҡ„дә§зү©жҳҜ Y 2 O 2 C пјҺ X е’Ңж°ўе…ғзҙ еҪўжҲҗзҰ»еӯҗеҢ–еҗҲзү© D пјҺ 6 Y е’Ң 7 Y дә’дёәеҗҢзҙ ејӮеҪўдҪ“ |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
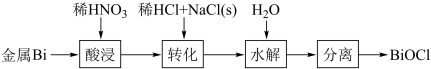
BiOCl жҳҜдёҖз§Қе…·жңүзҸ е…үжіҪзҡ„жқҗж–ҷпјҢеҲ©з”ЁйҮ‘еұһ Bi еҲ¶еӨҮ BiOCl зҡ„е·ҘиүәжөҒзЁӢеҰӮеӣҫпјҡ дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ й…ёжөёе·ҘеәҸдёӯеҲҶж¬ЎеҠ е…ҘзЁҖ HNO 3 еҸҜйҷҚдҪҺеҸҚеә”еү§зғҲзЁӢеәҰ B пјҺ иҪ¬еҢ–е·ҘеәҸдёӯеҠ е…ҘзЁҖ HCl еҸҜжҠ‘еҲ¶з”ҹжҲҗ BiONO 3 C пјҺ ж°ҙи§Је·ҘеәҸдёӯеҠ е…Ҙе°‘йҮҸ CH 3 COONa(s) еҸҜжҸҗй«ҳ Bi 3+ ж°ҙи§ЈзЁӢеәҰ D пјҺ ж°ҙи§Је·ҘеәҸдёӯеҠ е…Ҙе°‘йҮҸ NH 4 NO 3 (s) жңүеҲ©дәҺ BiOCl зҡ„з”ҹжҲҗ |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
N A жҳҜйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ 22.4L( ж ҮеҮҶзҠ¶еҶө ) ж°ҹж°”жүҖеҗ«зҡ„иҙЁеӯҗж•°дёә 18N A B пјҺ 1mol зўҳи’ёж°”е’Ң 1mol ж°ўж°”еңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”пјҢз”ҹжҲҗзҡ„зўҳеҢ–ж°ўеҲҶеӯҗж•°е°ҸдәҺ 2N A C пјҺ з”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙж—¶пјҢиӢҘйҳҙйҳідёӨжһҒдә§з”ҹж°”дҪ“зҡ„жҖ»иҙЁйҮҸдёә 73g пјҢеҲҷиҪ¬з§»з”өеӯҗж•°дёә N A D пјҺ 1L1molвҖўL -1 жәҙеҢ–й“өж°ҙжә¶ж¶Ідёӯ NH |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
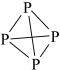
иӢҜ并йҷҚеҶ°зүҮзғҜжҳҜдёҖз§ҚйҮҚиҰҒзҡ„иҚҜзү©еҗҲжҲҗдёӯй—ҙдҪ“пјҢз»“жһ„з®ҖејҸеҰӮеӣҫгҖӮе…ідәҺиҜҘеҢ–еҗҲзү©пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A пјҺ жҳҜиӢҜзҡ„еҗҢзі»зү© B пјҺ еҲҶеӯҗдёӯжңҖеӨҡ 8 дёӘзўіеҺҹеӯҗе…ұе№ійқў C пјҺ дёҖж°Ҝд»Јзү©жңү 6 з§Қ ( дёҚиҖғиҷ‘з«ӢдҪ“ејӮжһ„ ) D пјҺ еҲҶеӯҗдёӯеҗ«жңү 4 дёӘзўізўіеҸҢй”® |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
KвҖ”O 2 з”өжұ з»“жһ„еҰӮеӣҫпјҢ a е’Ң b дёәдёӨдёӘз”өжһҒпјҢе…¶дёӯд№ӢдёҖдёәеҚ•иҙЁй’ҫзүҮгҖӮе…ідәҺиҜҘз”өжұ пјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ йҡ”иҶңе…Ғи®ё K + йҖҡиҝҮпјҢдёҚе…Ғи®ё O 2 йҖҡиҝҮ B пјҺ ж”ҫз”өж—¶пјҢз”өжөҒз”ұ b з”өжһҒжІҝеҜјзәҝжөҒеҗ‘ a з”өжһҒпјӣе……з”өж—¶пјҢ b з”өжһҒдёәйҳіжһҒ C пјҺ дә§з”ҹ 1Ah з”өйҮҸж—¶пјҢз”ҹжҲҗ KO 2 зҡ„иҙЁйҮҸдёҺж¶ҲиҖ— O 2 зҡ„иҙЁйҮҸжҜ”еҖјзәҰдёә 2.22 D пјҺ з”ЁжӯӨз”өжұ дёәй“…й…ёи“„з”өжұ е……з”өпјҢж¶ҲиҖ— 3.9g й’ҫж—¶пјҢй“…й…ёи“„з”өжұ ж¶ҲиҖ— 0.9g ж°ҙ |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺйқһйҮ‘еұһеҗ«ж°§й…ёеҸҠе…¶зӣҗзҡ„жҖ§иҙЁпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A пјҺ жө“ H 2 SO 4 е…·жңүејәеҗёж°ҙжҖ§пјҢиғҪеҗёж”¶зі–зұ»еҢ–еҗҲзү©дёӯзҡ„ж°ҙеҲҶ并дҪҝе…¶зӮӯеҢ– B пјҺ NaClO гҖҒ KClO 3 зӯүж°Ҝзҡ„еҗ«ж°§й…ёзӣҗзҡ„ж°§еҢ–жҖ§дјҡйҡҸжә¶ж¶Ізҡ„ pH еҮҸе°ҸиҖҢеўһејә C пјҺ еҠ зғӯ NaI дёҺжө“ H 3 PO 4 ж··еҗҲзү©еҸҜеҲ¶еӨҮ HI пјҢиҜҙжҳҺ H 3 PO 4 жҜ” HI й…ёжҖ§ејә D пјҺ жө“ HNO 3 е’ҢзЁҖ HNO 3 дёҺ Cu еҸҚеә”зҡ„иҝҳеҺҹдә§зү©еҲҶеҲ«дёә NO 2 е’Ң NO пјҢж•…зЁҖ HNO 3 ж°§еҢ–жҖ§жӣҙејә |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
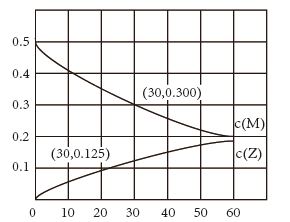
е®Өжё©дёӢпјҢжҹҗжә¶ж¶ІеҲқе§Ӣж—¶д»…жә¶жңү M е’Ң N дё”жө“еәҰзӣёзӯүпјҢеҗҢж—¶еҸ‘з”ҹд»ҘдёӢдёӨдёӘеҸҚеә”пјҡ в‘ M+N=X+Y пјӣ в‘Ў M+N=X+Z пјҢеҸҚеә” в‘ зҡ„йҖҹзҺҮеҸҜиЎЁзӨәдёә v 1 =k 1 c 2 (M) пјҢеҸҚеә” в‘Ўзҡ„йҖҹзҺҮеҸҜиЎЁзӨәдёә v 2 =k 2 c 2 (M) (k 1 гҖҒ k 2 дёәйҖҹзҺҮеёёж•° ) гҖӮеҸҚеә”дҪ“зі»дёӯз»„еҲҶ M гҖҒ Z зҡ„жө“еәҰйҡҸж—¶й—ҙеҸҳеҢ–жғ…еҶөеҰӮеӣҫпјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ 0 пҪһ 30min ж—¶й—ҙж®өеҶ…пјҢ Y зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә 6.67Г—10 -8 molвҖўL -1 вҖўmin -1 B пјҺ еҸҚеә”ејҖе§ӢеҗҺпјҢдҪ“зі»дёӯ Y е’Ң Z зҡ„жө“еәҰд№ӢжҜ”дҝқжҢҒдёҚеҸҳ C пјҺ еҰӮжһңеҸҚеә”иғҪиҝӣиЎҢеҲ°еә•пјҢеҸҚеә”з»“жқҹж—¶ 62.5% зҡ„ M иҪ¬еҢ–дёә Z D пјҺ еҸҚеә” в‘ зҡ„жҙ»еҢ–иғҪжҜ”еҸҚеә”в‘Ўзҡ„жҙ»еҢ–иғҪеӨ§ |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
еҰӮеӣҫжүҖзӨәзҡ„дёӨз§ҚеҢ–еҗҲзү©еҸҜеә”з”ЁдәҺйҳ»зҮғжқҗж–ҷе’Ңз”ҹзү©жқҗж–ҷзҡ„еҗҲжҲҗгҖӮе…¶дёӯ W гҖҒ X гҖҒ Y гҖҒ Z дёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹе…ғзҙ пјҢ X е’Ң Z еҗҢдё»ж—ҸпјҢ Y еҺҹеӯҗеәҸж•°дёә W еҺҹеӯҗд»·з”өеӯҗж•°зҡ„ 3 еҖҚгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A пјҺ X е’Ң Z зҡ„жңҖй«ҳеҢ–еҗҲд»·еқҮдёә +7 д»· B пјҺ HX е’Ң HZ еңЁж°ҙдёӯеқҮдёәејәй…ёпјҢз”өеӯҗејҸеҸҜиЎЁзӨәдёә C пјҺ еӣӣз§Қе…ғзҙ дёӯпјҢ Y еҺҹеӯҗеҚҠеҫ„жңҖеӨ§пјҢ X еҺҹеӯҗеҚҠеҫ„жңҖе°Ҹ D пјҺ Z гҖҒ W е’Ңж°ўдёүз§Қе…ғзҙ еҸҜеҪўжҲҗеҗҢж—¶еҗ«жңүзҰ»еӯҗй”®е’Ңе…ұд»·й”®зҡ„еҢ–еҗҲзү© |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
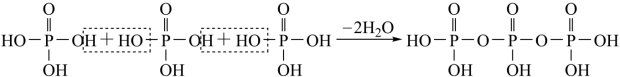
з•ӘжңЁйі–й…ёе…·жңүдёҖе®ҡзҡ„жҠ—зӮҺгҖҒжҠ—иҸҢжҙ»жҖ§пјҢз»“жһ„з®ҖејҸеҰӮеӣҫгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A пјҺ 1mol иҜҘзү©иҙЁдёҺи¶ійҮҸйҘұе’Ң NaHCO 3 жә¶ж¶ІеҸҚеә”пјҢеҸҜж”ҫеҮә 22.4L( ж ҮеҮҶзҠ¶еҶө )CO 2 B пјҺ дёҖе®ҡйҮҸзҡ„иҜҘзү©иҙЁеҲҶеҲ«дёҺи¶ійҮҸ Na гҖҒ NaOH еҸҚеә”пјҢж¶ҲиҖ—дәҢиҖ…зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә 5 пјҡ 1 C пјҺ 1mol иҜҘзү©иҙЁжңҖеӨҡеҸҜдёҺ 2molH 2 еҸ‘з”ҹеҠ жҲҗеҸҚеә” D пјҺ иҜҘзү©иҙЁеҸҜиў«й…ёжҖ§ KMnO 4 жә¶ж¶Іж°§еҢ– |
|
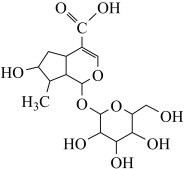
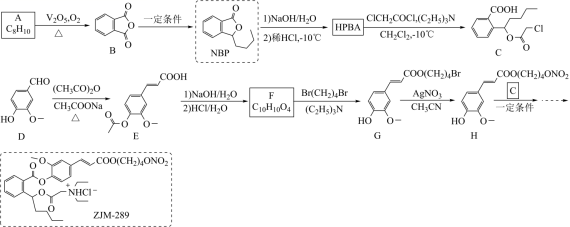
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҒиӢҜй…һ (NBP) жҳҜжҲ‘еӣҪжӢҘжңүе®Ңе…ЁиҮӘдё»зҹҘиҜҶдә§жқғзҡ„еҢ–еӯҰиҚҜзү©пјҢдёҙеәҠдёҠз”ЁдәҺжІ»з–—зјәиЎҖжҖ§и„‘еҚ’дёӯзӯүз–ҫз—…гҖӮ ZJM вҖ” 289 жҳҜдёҖз§Қ NBP ејҖзҺҜдҪ“ (HPBA) иЎҚз”ҹзү©пјҢеңЁдҪ“еҶ…еӨ–еҸҜз»Ҹй…¶дҝғжҲ–еҢ–еӯҰиҪ¬еҸҳжҲҗ NBP е’Ңе…¶е®ғжҙ»жҖ§жҲҗеҲҶпјҢе…¶еҗҲжҲҗи·ҜзәҝеҰӮеӣҫпјҡ е·ІзҹҘдҝЎжҒҜпјҡ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)A зҡ„еҢ–еӯҰеҗҚз§°дёә ___ гҖӮ (2)D жңүеӨҡз§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢе…¶дёӯиғҪеҗҢж—¶ж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„иҠійҰҷж—ҸеҢ–еҗҲзү©зҡ„з»“жһ„з®ҖејҸдёә ___ гҖҒ ___ гҖӮ в‘ еҸҜеҸ‘з”ҹ银й•ңеҸҚеә”пјҢд№ҹиғҪдёҺ FeCl 3 жә¶ж¶ІеҸ‘з”ҹжҳҫиүІеҸҚеә”пјӣ в‘Ўж ёзЈҒе…ұжҢҜж°ўи°ұжңүеӣӣз»„еі°пјҢеі°йқўз§ҜжҜ”дёә 1 вҲ¶ 2 вҲ¶ 2 вҲ¶ 3 гҖӮ (3)EвҶ’F дёӯ ( жӯҘйӘӨ 1) зҡ„еҢ–еӯҰж–№зЁӢејҸдёә __ гҖӮ (4)GвҶ’H зҡ„еҸҚеә”зұ»еһӢдёә ___ гҖӮиӢҘд»Ҙ NaNO 3 д»Јжӣҝ AgNO 3 пјҢеҲҷиҜҘеҸҚеә”йҡҫд»ҘиҝӣиЎҢпјҢ AgNO 3 еҜ№иҜҘеҸҚеә”зҡ„дҝғиҝӣдҪңз”Ёдё»иҰҒжҳҜеӣ дёә __ гҖӮ (5)HPBA зҡ„з»“жһ„з®ҖејҸдёә __ гҖӮйҖҡеёёй…ҜеҢ–еҸҚеә”йңҖеңЁй…ёеӮ¬еҢ–гҖҒеҠ зғӯжқЎд»¶дёӢиҝӣиЎҢпјҢеҜ№жҜ” HPBA е’Ң NBP зҡ„з»“жһ„пјҢиҜҙжҳҺеёёжё©дёӢ HPBA дёҚзЁіе®ҡгҖҒжҳ“иҪ¬еҢ–дёә NBP зҡ„дё»иҰҒеҺҹеӣ ___ гҖӮ (6)W жҳҜеҗҲжҲҗжҹҗз§ҚжҠ—з–ҹз–ҫиҚҜзү©зҡ„дёӯй—ҙдҪ“зұ»дјјзү©гҖӮи®ҫи®Ўз”ұ 2 пјҢ 4 вҖ”дәҢж°Ҝз”ІиӢҜ ( |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
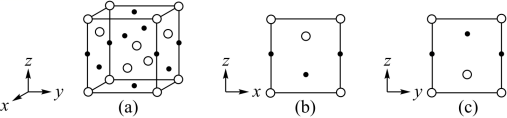
KH 2 PO 4 жҷ¶дҪ“е…·жңүдјҳејӮзҡ„йқһзәҝжҖ§е…үеӯҰжҖ§иғҪгҖӮжҲ‘еӣҪ科еӯҰе·ҘдҪңиҖ…еҲ¶еӨҮзҡ„и¶…еӨ§ KH 2 PO 4 жҷ¶дҪ“е·Іеә”з”ЁдәҺеӨ§еҠҹзҺҮеӣәдҪ“жҝҖе…үеҷЁпјҢеЎ«иЎҘдәҶеӣҪ家жҲҳз•Ҙз©әзҷҪгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1) еңЁ KH 2 PO 4 зҡ„еӣӣз§Қз»„жҲҗе…ғзҙ еҗ„иҮӘжүҖиғҪеҪўжҲҗзҡ„з®ҖеҚ•зҰ»еӯҗдёӯпјҢж ёеӨ–з”өеӯҗжҺ’еёғзӣёеҗҢзҡ„жҳҜ __ ( еЎ«зҰ»еӯҗз¬ҰеҸ· ) гҖӮ (2) еҺҹеӯҗдёӯиҝҗеҠЁзҡ„з”өеӯҗжңүдёӨз§ҚзӣёеҸҚзҡ„иҮӘж—ӢзҠ¶жҖҒпјҢиӢҘдёҖз§ҚиҮӘж—ӢзҠ¶жҖҒз”Ё + (3) е·ІзҹҘжңүе…іж°ЁгҖҒзЈ·зҡ„еҚ•й”®е’Ңдёүй”®зҡ„й”®иғҪ (kJ вҖў mol -1 ) еҰӮиЎЁпјҡ
д»ҺиғҪйҮҸи§’еәҰзңӢпјҢж°®д»Ҙ N 2 гҖҒиҖҢзҷҪзЈ·д»Ҙ P 4 ( з»“жһ„ејҸеҸҜиЎЁзӨәдёә (4) е·ІзҹҘ KH 2 PO 4 жҳҜж¬ЎзЈ·й…ёзҡ„жӯЈзӣҗпјҢ H 3 PO 2 зҡ„з»“жһ„ејҸдёә ___ пјҢе…¶дёӯ P йҮҮеҸ– ___ жқӮеҢ–ж–№ејҸгҖӮ (5) дёҺ PO (6) зЈ·й…ёйҖҡиҝҮеҲҶеӯҗй—ҙи„ұж°ҙзј©еҗҲеҪўжҲҗеӨҡзЈ·й…ёпјҢеҰӮпјҡ еҰӮжһңжңү n дёӘзЈ·й…ёеҲҶеӯҗй—ҙи„ұж°ҙеҪўжҲҗзҺҜзҠ¶зҡ„еӨҡзЈ·й…ёпјҢеҲҷзӣёеә”зҡ„й…ёж №еҸҜеҶҷдёә ___ гҖӮ (7) еҲҶеҲ«з”Ё в—Ӣ гҖҒ в—Ҹ иЎЁзӨә H 2 PO в‘ иӢҘжҷ¶иғһеә•иҫ№зҡ„иҫ№й•ҝеқҮдёә apm гҖҒй«ҳдёә cpm пјҢйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёә N A пјҢжҷ¶дҪ“зҡ„еҜҶеәҰ __ g вҖў cm -3 ( еҶҷеҮәиЎЁиҫҫејҸ ) гҖӮ в‘Ўжҷ¶иғһеңЁ x иҪҙж–№еҗ‘зҡ„жҠ•еҪұеӣҫдёә __ ( еЎ«ж ҮеҸ· ) гҖӮ |
|||||||||
| 16. | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
еҪ“д»ҠпјҢдё–з•ҢеӨҡеӣҪзӣёз»§и§„еҲ’дәҶзўіиҫҫеі°гҖҒзўідёӯе’Ңзҡ„ж—¶й—ҙиҠӮзӮ№гҖӮеӣ жӯӨпјҢз ”еҸ‘дәҢж°§еҢ–зўіеҲ©з”ЁжҠҖжңҜпјҢйҷҚдҪҺз©әж°”дёӯдәҢж°§еҢ–зўіеҗ«йҮҸжҲҗдёәз ”з©¶зғӯзӮ№гҖӮ (1) еӨ§ж°”дёӯзҡ„дәҢж°§еҢ–зўідё»иҰҒжқҘиҮӘдәҺз…ӨгҖҒзҹіжІ№еҸҠе…¶д»–еҗ«зўіеҢ–еҗҲзү©зҡ„зҮғзғ§гҖӮе·ІзҹҘ 25 в„ғж—¶пјҢзӣёе…ізү©иҙЁзҡ„зҮғзғ§зғӯж•°жҚ®еҰӮиЎЁпјҡ
(1) еҲҷ 25 в„ғж—¶ H 2 (g) е’Ң C( зҹіеўЁпјҢ s) з”ҹжҲҗ C 6 H 6 (l) зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸдёә ________ гҖӮ (2) йӣЁж°ҙдёӯеҗ«жңүжқҘиҮӘеӨ§ж°”зҡ„ CO 2 пјҢжә¶дәҺж°ҙдёӯзҡ„ CO 2 иҝӣдёҖжӯҘе’Ңж°ҙеҸҚеә”пјҢеҸ‘з”ҹз”өзҰ»пјҡ в‘ CO 2 (g)=CO 2 (aq) в‘Ў CO 2 (aq)+H 2 O(l)=H + (aq)+HCO 25 в„ғж—¶пјҢеҸҚеә”в‘Ўзҡ„е№іиЎЎеёёж•°дёә K 2 гҖӮ жә¶ж¶Ідёӯ CO 2 зҡ„жө“еәҰдёҺе…¶еңЁз©әж°”дёӯзҡ„еҲҶеҺӢжҲҗжӯЈжҜ” ( еҲҶеҺӢ = жҖ»еҺӢ Г— зү©иҙЁзҡ„йҮҸеҲҶж•° ) пјҢжҜ”дҫӢзі»ж•°дёә ymol вҖў L -1 вҖў kPa -1 пјҢеҪ“еӨ§ж°”еҺӢејәдёә pkPa пјҢеӨ§ж°”дёӯ CO 2 (g) зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёә x ж—¶пјҢжә¶ж¶Ідёӯ H + жө“еәҰдёә ________ mol вҖў L -1 ( еҶҷеҮәиЎЁиҫҫејҸпјҢиҖғиҷ‘ж°ҙзҡ„з”өзҰ»пјҢеҝҪз•Ҙ HCO (3)105 в„ғж—¶пјҢе°Ҷи¶ійҮҸзҡ„жҹҗзўій…ёж°ўзӣҗ (MHCO 3 ) еӣәдҪ“зҪ®дәҺзңҹз©әжҒ’е®№е®№еҷЁдёӯпјҢеӯҳеңЁеҰӮдёӢе№іиЎЎпјҡ 2MHCO 3 (s) дҝқжҢҒжё©еәҰдёҚеҸҳпјҢејҖе§Ӣж—¶еңЁдҪ“зі»дёӯе…ҲйҖҡе…ҘдёҖе®ҡйҮҸзҡ„ CO 2 (g) пјҢеҶҚеҠ е…Ҙи¶ійҮҸ MHCO 3 (s) пјҢж¬ІдҪҝе№іиЎЎж—¶дҪ“зі»дёӯж°ҙи’ёж°”зҡ„еҲҶеҺӢе°ҸдәҺ 5kPa пјҢ CO 2 (g) зҡ„еҲқе§ӢеҺӢејәеә”еӨ§дәҺ ________ kPa гҖӮ (4) жҲ‘еӣҪ科еӯҰе®¶з ”з©¶ Li вҖ” CO 2 з”өжұ пјҢеҸ–еҫ—дәҶйҮҚеӨ§з§‘з ”жҲҗжһңпјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ в‘ Li вҖ” CO 2 з”өжұ дёӯпјҢ Li дёәеҚ•иҙЁй”ӮзүҮпјҢеҲҷиҜҘз”өжұ дёӯзҡ„ CO 2 еңЁ ___ ( еЎ« вҖң жӯЈ вҖқ жҲ– вҖң иҙҹ вҖқ) жһҒеҸ‘з”ҹз”өеҢ–еӯҰеҸҚеә”гҖӮз ”з©¶иЎЁжҳҺпјҢиҜҘз”өжұ еҸҚеә”дә§зү©дёәзўій…ёй”Ӯе’ҢеҚ•иҙЁзўіпјҢдё” CO 2 з”өиҝҳеҺҹеҗҺдёҺй”ӮзҰ»еӯҗз»“еҗҲеҪўжҲҗзўій…ёй”ӮжҢүд»ҘдёӢ 4 дёӘжӯҘйӘӨиҝӣиЎҢпјҢеҶҷеҮәжӯҘйӘӨ в…ўзҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ в… .2CO 2 +2e - =C 2 O в…ў . __________ в…Ј .CO в‘Ўз ”з©¶иЎЁжҳҺпјҢеңЁз”өи§ЈиҙЁж°ҙжә¶ж¶ІдёӯпјҢ CO 2 ж°”дҪ“еҸҜиў«з”өеҢ–еӯҰиҝҳеҺҹгҖӮ в… .CO 2 еңЁзўұжҖ§д»ӢиҙЁдёӯз”өиҝҳеҺҹдёәжӯЈдёҷйҶҮ (CH 3 CH 2 CH 2 OH) зҡ„з”өжһҒеҸҚеә”ж–№зЁӢејҸдёә _________ гҖӮ в…Ў . еңЁз”өи§ЈиҙЁж°ҙжә¶ж¶ІдёӯпјҢдёүз§ҚдёҚеҗҢеӮ¬еҢ–еүӮ (a гҖҒ b гҖҒ c) дёҠ CO 2 з”өиҝҳеҺҹдёә CO зҡ„еҸҚеә”иҝӣзЁӢдёӯ (H + иў«иҝҳеҺҹдёә H 2 зҡ„еҸҚеә”еҸҜеҗҢж—¶еҸ‘з”ҹ ) пјҢзӣёеҜ№иғҪйҮҸеҸҳеҢ–еҰӮеӣҫ . з”ұжӯӨеҲӨж–ӯпјҢ CO 2 з”өиҝҳеҺҹдёә CO д»Һжҳ“еҲ°йҡҫзҡ„йЎәеәҸдёә _______ ( з”Ё a гҖҒ b гҖҒ c еӯ—жҜҚжҺ’еәҸ ) гҖӮ |
|||||||||
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
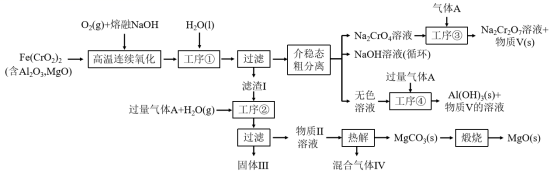
з»ҝиүІеҢ–еӯҰеңЁжҺЁеҠЁзӨҫдјҡеҸҜжҢҒз»ӯеҸ‘еұ•дёӯеҸ‘жҢҘзқҖйҮҚиҰҒдҪңз”ЁгҖӮжҹҗз§‘з ”еӣўйҳҹи®ҫи®ЎдәҶдёҖз§ҚзҶ”зӣҗж¶Ізӣёж°§еҢ–жі•еҲ¶еӨҮй«ҳ价铬зӣҗзҡ„ж–°е·ҘиүәпјҢиҜҘе·ҘиүәдёҚж¶ҲиҖ—йҷӨ铬й“ҒзҹҝгҖҒж°ўж°§еҢ–й’ е’Ңз©әж°”д»ҘеӨ–зҡ„е…¶д»–еҺҹж–ҷпјҢдёҚдә§з”ҹеәҹејғзү©пјҢе®һзҺ°дәҶ CrвҖ”FeвҖ”AlвҖ”Mg зҡ„ж·ұеәҰеҲ©з”Ёе’Ң Na + еҶ…еҫӘзҺҜгҖӮе·ҘиүәжөҒзЁӢеҰӮеӣҫпјҡ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1) й«ҳжё©иҝһз»ӯж°§еҢ–е·ҘеәҸдёӯиў«ж°§еҢ–зҡ„е…ғзҙ жҳҜ ___ ( еЎ«е…ғзҙ з¬ҰеҸ· ) гҖӮ (2) е·ҘеәҸ в‘ зҡ„еҗҚз§°дёә __ гҖӮ (3) ж»ӨжёЈзҡ„дё»иҰҒжҲҗеҲҶжҳҜ __ ( еЎ«еҢ–еӯҰејҸ ) гҖӮ (4) е·ҘеәҸ в‘ўдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә ___ гҖӮ (5) зү©иҙЁ V еҸҜд»Јжӣҝй«ҳжё©иҝһз»ӯж°§еҢ–е·ҘеәҸдёӯзҡ„ NaOH пјҢжӯӨж—¶еҸ‘з”ҹзҡ„дё»иҰҒеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә __ пјҢеҸҜд»Јжӣҝ NaOH зҡ„еҢ–еӯҰиҜ•еүӮиҝҳжңү ___ ( еЎ«еҢ–еӯҰејҸ ) гҖӮ (6) зғӯи§Је·ҘеәҸдә§з”ҹзҡ„ж··еҗҲж°”дҪ“жңҖйҖӮе®ңиҝ”еӣһе·ҘеәҸ ___ ( еЎ« вҖң в‘ вҖқ жҲ– вҖң в‘Ў вҖқ жҲ– вҖң в‘ў вҖқ жҲ– вҖң в‘Ј вҖқ) еҸӮдёҺеҶ…еҫӘзҺҜгҖӮ (7) е·ҘеәҸ в‘Јжә¶ж¶Ідёӯзҡ„й“қе…ғзҙ жҒ°еҘҪе®Ңе…ЁиҪ¬еҢ–дёәжІүж·Җзҡ„ pH дёә __ гҖӮ ( йҖҡеёёи®Өдёәжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰе°ҸдәҺ 10 -5 molвҖўL -1 дёәжІүж·Җе®Ңе…Ёпјӣ A1(OH) 3 +OH - |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
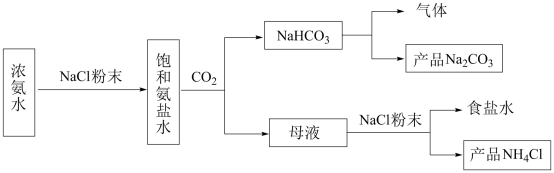
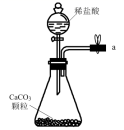
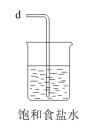
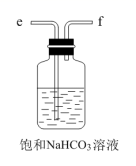
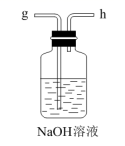
еҢ–е·Ҙ专家дҫҜеҫ·жҰңеҸ‘жҳҺзҡ„дҫҜж°ҸеҲ¶зўұжі•дёәжҲ‘еӣҪзәҜзўұе·Ҙдёҡе’ҢеӣҪж°‘з»ҸжөҺеҸ‘еұ•еҒҡеҮәдәҶйҮҚиҰҒиҙЎзҢ®пјҢжҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„еңЁе®һйӘҢе®ӨдёӯжЁЎжӢҹ并改иҝӣдҫҜж°ҸеҲ¶зўұжі•еҲ¶еӨҮ NaHCO 3 пјҢиҝӣдёҖжӯҘеӨ„зҗҶеҫ—еҲ°дә§е“Ғ Na 2 CO 3 е’Ң NH 4 Cl пјҢе®һйӘҢжөҒзЁӢеҰӮеӣҫпјҡ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1) д»Һ A пҪһ E дёӯйҖүжӢ©еҗҲйҖӮзҡ„д»ӘеҷЁеҲ¶еӨҮ NaHCO 3 пјҢжӯЈзЎ®зҡ„иҝһжҺҘйЎәеәҸжҳҜ ___ ( жҢүж°”жөҒж–№еҗ‘пјҢз”Ёе°ҸеҶҷеӯ—жҜҚиЎЁзӨә ) гҖӮдёәдҪҝ A дёӯеҲҶж¶ІжјҸж–—еҶ…зҡ„зЁҖзӣҗй…ёйЎәеҲ©ж»ҙдёӢпјҢеҸҜе°ҶеҲҶж¶ІжјҸж–—дёҠйғЁзҡ„зҺ»з’ғеЎһжү“ејҖжҲ– ___ гҖӮ AпјҺ (2)B дёӯдҪҝз”ЁйӣҫеҢ–иЈ…зҪ®зҡ„дјҳзӮ№жҳҜ __ гҖӮ (3) з”ҹжҲҗ NaHCO 3 зҡ„жҖ»еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә ___ гҖӮ (4) еҸҚеә”е®ҢжҲҗеҗҺпјҢе°Ҷ B дёӯ U еҪўз®ЎеҶ…зҡ„ж··еҗҲзү©еӨ„зҗҶеҫ—еҲ°еӣәдҪ“ NaHCO 3 е’Ңж»Өж¶Іпјҡ в‘ еҜ№еӣәдҪ“ NaHCO 3 е……еҲҶеҠ зғӯпјҢдә§з”ҹзҡ„ж°”дҪ“е…ҲйҖҡиҝҮи¶ійҮҸжө“зЎ«й…ёпјҢеҶҚйҖҡиҝҮи¶ійҮҸ Na 2 O 2 пјҢ Na 2 O 2 еўһйҮҚ 0.14g пјҢеҲҷеӣәдҪ“ NaHCO 3 зҡ„иҙЁйҮҸдёә ___ g гҖӮ в‘Ўеҗ‘ж»Өж¶ІдёӯеҠ е…Ҙ NaCl зІүжң«пјҢеӯҳеңЁ NaCl(s)+NH 4 Cl(aq)вҶ’NaCl(aq)+NH 4 Cl(s) иҝҮзЁӢгҖӮдёәдҪҝ NH 4 Cl жІүж·Җе……еҲҶжһҗеҮә并еҲҶзҰ»пјҢж №жҚ® NaCl е’Ң NH 4 Cl жә¶и§ЈеәҰжӣІзәҝпјҢйңҖйҮҮз”Ёзҡ„ж“ҚдҪңдёә ___ гҖҒ ___ гҖҒжҙ—ж¶ӨгҖҒе№ІзҮҘгҖӮ (5) ж— ж°ҙ NaHCO 3 еҸҜдҪңдёәеҹәеҮҶзү©иҙЁж Үе®ҡзӣҗй…ёжө“еәҰ . з§°йҮҸеүҚпјҢиӢҘж— ж°ҙ NaHCO 3 дҝқеӯҳдёҚеҪ“пјҢеҗёж”¶дәҶдёҖе®ҡйҮҸж°ҙеҲҶпјҢз”Ёе…¶ж Үе®ҡзӣҗй…ёжө“еәҰж—¶пјҢдјҡдҪҝз»“жһң ___ ( еЎ«ж ҮеҸ· ) гҖӮ AпјҺ еҒҸй«ҳ BпјҺ еҒҸдҪҺ дёҚеҸҳ |
|
- 2019-2020е№ҙж–°ж–°ж•ҷжқҗеҗҢжӯҘдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰеҝ…дҝ®з¬¬дёҖеҶҢ иҙЁйҮҸжЈҖжөӢ
- й«ҳдёҖ12жңҲжңҲиҖғеҢ–еӯҰйўҳеҗҢжӯҘи®ӯз»ғе…Қиҙ№иҜ•еҚ·пјҲ2019-2020е№ҙеұұиҘҝзңҒжҷӢдёӯеёӮзҘҒеҺҝдёӯеӯҰж Ўпјү
- еёёеҫ·еёӮй«ҳдәҢеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еұұдёңжөҺеҚ—еёӮеҺҶеҹҺ第дәҢдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹејҖеӯҰиҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- еӨ©жҙҘеёӮ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеӯҰжңҹй«ҳиҖғжЁЎжӢҹеҗҢжӯҘз»ғд№
- 2019-2020е№ҙй«ҳдёҖдёҠеӯҰжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиҘҝзңҒдёҠйҘ¶еёӮдёҠйҘ¶дёӯеӯҰпјү
- й«ҳдәҢеҢ–еӯҰдёӢеҶҢеҚ•е…ғжөӢиҜ•йўҳе…Қиҙ№иҜ•еҚ·
- е®ңжҳҢеёӮй«ҳдәҢеҢ–еӯҰ2019е№ҙдёӢеҶҢжңҲиҖғжөӢйӘҢеңЁзәҝеҒҡйўҳ