2019еҗүжһ—й«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁжҳҜзәҜеҮҖзү©зҡ„жҳҜ(гҖҖгҖҖ) AпјҺзҺ»з’ғ В В В В В В В В В В В В В BпјҺж°ҙжіҘВ В В В В В В В В CпјҺзәҜзўұВ В В В В В В В В В В В В В В DпјҺж°ҙзҺ»з’ғ |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңдёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺи’ёеҸ‘ж“ҚдҪңж—¶пјҢеә”дҪҝж··еҗҲзү©дёӯзҡ„ж°ҙеҲҶе®Ңе…Ёи’ёе№ІеҗҺжүҚиғҪеҒңжӯўеҠ зғӯ BпјҺи’ёйҰҸж“ҚдҪңж—¶пјҢеә”дҪҝжё©еәҰи®Ўж°ҙ银зҗғйқ иҝ‘и’ёйҰҸзғ§з“¶ж”Ҝз®ЎеҸЈеӨ„ CпјҺеҲҶж¶Іж“ҚдҪңж—¶пјҢеҲҶж¶ІжјҸж–—дёӯдёӢеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәеҗҺпјҢеҶҚе°ҶдёҠеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәеҲ°еҸҰдёҖдёӘзғ§жқҜ DпјҺиҗғеҸ–ж“ҚдҪңж—¶пјҢеә”йҖүжӢ©жңүжңәиҗғеҸ–еүӮпјҢдё”иҗғеҸ–еүӮзҡ„еҜҶеәҰеҝ…йЎ»жҜ”ж°ҙеӨ§ |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„дёӯдёӨз§Қзү©иҙЁдҪңз”Ёж—¶пјҢеҸҚеә”жқЎд»¶жҲ–еҸҚеә”зү©з”ЁйҮҸж”№еҸҳпјҢеҜ№з”ҹжҲҗзү©жІЎжңүеҪұе“Қзҡ„жҳҜ(гҖҖгҖҖ) AпјҺNaдёҺO2В В В В В В В В В В В В В В BпјҺNa2O2дёҺCO2В В В CпјҺNaOHжә¶ж¶ІдёҺCO2В В В В В В DпјҺAlCl3жә¶ж¶ІдёҺNaOHжә¶ж¶І |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘжҹҗжә¶ж¶Іеҗ«жңүNaпјӢгҖҒBa2пјӢгҖҒFe2пјӢдёүз§ҚйҳізҰ»еӯҗпјҢйӮЈд№Ҳжә¶ж¶Ідёӯзҡ„йҳҙзҰ»еӯҗеҸҜиғҪжҳҜ (гҖҖгҖҖ) AпјҺSO В CпјҺOHпјҚВ В В В В В В В В В В В В В В В В DпјҺCO |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёҖе°Ҹеқ—й’ жҠ•е…ҘеҲ°FeCl3жә¶ж¶ІдёӯпјҢи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜ(гҖҖгҖҖ) AпјҺй’ жә¶и§ЈпјҢжңүй“ҒжһҗеҮә并жңүж°”дҪ“дә§з”ҹВ В В В В В В В В В BпјҺеҸӘжңүж°”дҪ“дә§з”ҹ CпјҺж—ўжңүж°”дҪ“дә§з”ҹпјҢеҸҲжңүзәўиӨҗиүІжІүж·Җдә§з”ҹВ В В В В В DпјҺеҸӘжңүжІүж·Җдә§з”ҹ |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ«й…ёдәҡй“Ғжә¶ж¶Іеҗ«жңүжқӮиҙЁзЎ«й…ёй“ңе’ҢзЎ«й…ёй“ҒпјҢдёәйҷӨеҺ»жқӮиҙЁпјҢжҸҗзәҜзЎ«й…ёдәҡй“ҒпјҢеә”иҜҘеҠ е…ҘдёӢеҲ—е“Әз§Қзү©иҙЁ (гҖҖгҖҖ) AпјҺй”ҢзІүВ В В В В В В В BпјҺй•ҒзІүВ В В В В В В В CпјҺй“ҒзІүВ В В В В В В В DпјҺй“қзІү |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дәҢж°§еҢ–зЎ…еұһдәҺй…ёжҖ§ж°§еҢ–зү©пјҢзҗҶз”ұжҳҜ (гҖҖгҖҖ) AпјҺзЎ…еұһдәҺйқһйҮ‘еұһе…ғзҙ В В В В В В В В В В В В В В В BпјҺSiO2еҜ№еә”зҡ„ж°ҙеҢ–зү©жҳҜеҸҜжә¶жҖ§ејұй…ё CпјҺSiO2дёҺејәзўұеҸҚеә”з”ҹжҲҗзӣҗе’Ңж°ҙВ В В В В В В DпјҺSiO2дёҚиғҪдёҺй…ёеҸҚеә” |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е…үзәӨйҖҡдҝЎжҳҜд»Ҙе…үдҪңдёәдҝЎжҒҜзҡ„иҪҪдҪ“пјҢи®©е…үеңЁе…үеҜјзәӨз»ҙдёӯдј ж’ӯпјҢеҲ¶йҖ е…үеҜјзәӨз»ҙзҡ„еҹәжң¬еҺҹж–ҷжҳҜ (гҖҖгҖҖ) AпјҺж°§еҢ–й’ҷВ В В В В В В В В В В В В В В В В В В В В В В В В BпјҺй“ңВ В В В В В В В В CпјҺдәҢж°§еҢ–зЎ…В В В В В В В В В В В В В В В В В В В В В В В DпјҺзЎ… |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘дёӢеҲ—жә¶ж¶Ідёӯж»ҙеҠ зЁҖзЎ«й…ёз”ҹжҲҗзҷҪиүІжІүж·ҖпјҢ继з»ӯж»ҙеҠ зЁҖзЎ«й…ёпјҢжІүж·Җжә¶и§Јзҡ„жҳҜ(гҖҖгҖҖ) AпјҺNa2SiO3В В В В В В В В BпјҺBaCl2В В В В В В В В CпјҺFeCl3В В В В В В В В В В В DпјҺNaAlO2 |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізЎ…еҸҠе…¶еҢ–еҗҲзү©зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ) AпјҺжҷ¶дҪ“зЎ…е…·жңүйҮ‘еұһе…үжіҪпјҢеҸҜд»ҘеҜјз”өпјҢеұһдәҺйҮ‘еұһжқҗж–ҷ BпјҺеёёжё©дёӢпјҢзЎ…зҡ„еҢ–еӯҰжҖ§иҙЁзЁіе®ҡпјҢжүҖд»ҘиҮӘ然з•Ңдёӯзҡ„зЎ…еӨ§йғЁеҲҶд»ҘжёёзҰ»жҖҒеӯҳеңЁ CпјҺSiO2жҳҜдёҖз§Қй…ёжҖ§ж°§еҢ–зү©пјҢиғҪеӨҹдёҺж°ҙеҸҚеә”з”ҹжҲҗзӣёеә”зҡ„й…ё DпјҺйҷӨеҺ»SiO2дёӯж··жңүзҡ„CaCO3еҸҜеҠ е…ҘйҖӮйҮҸзҡ„зЁҖзӣҗй…ё |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жҲ‘们常用вҖңеҫҖдјӨеҸЈдёҠж’’зӣҗвҖқжқҘжҜ”е–»жҹҗдәӣдәәд№ҳдәәд№ӢеҚұзҡ„иЎҢдёәпјҢе…¶е®һд»ҺеҢ–еӯҰзҡ„и§’еәҰжқҘиҜҙпјҢвҖңеҫҖдјӨеҸЈдёҠж’’зӣҗвҖқзҡ„еҒҡжі•е№¶ж— дёҚеҰҘпјҢз”ҡиҮіеҸҜд»ҘиҜҙ并дёҚжҳҜе®ідәәиҖҢжҳҜж•‘дәәгҖӮйӮЈд№ҲпјҢиҝҷз§ҚеҒҡжі•зҡ„еҢ–еӯҰеҺҹзҗҶжҳҜВ В В В В В В В В (гҖҖгҖҖ) AпјҺиғ¶дҪ“зҡ„з”өжііВ В В В В В В В В В В В В BпјҺиЎҖж¶Ізҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”В В В CпјҺиЎҖж¶ІдёӯеҸ‘з”ҹеӨҚеҲҶи§ЈеҸҚеә”В В В DпјҺиғ¶дҪ“зҡ„иҒҡжІү |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺж°ҙеҜјз”өжҖ§еҫҲе·®пјҢжүҖд»Ҙж°ҙжҳҜйқһз”өи§ЈиҙЁ BпјҺз”өи§ЈиҙЁдёҺйқһз”өи§ЈиҙЁзҡ„жң¬иҙЁеҢәеҲ«жҳҜеңЁдёҖе®ҡжқЎд»¶дёӢеҢ–еҗҲзү©иҮӘиә«иғҪеҗҰз”өзҰ» CпјҺй…ёгҖҒзўұе’Ңзӣҗзұ»йғҪеұһдәҺз”өи§ЈиҙЁпјҢе…¶д»–еҢ–еҗҲзү©йғҪжҳҜйқһз”өи§ЈиҙЁ DпјҺNaClе’ҢHClйғҪжҳҜз”өи§ЈиҙЁпјҢжүҖд»Ҙе®ғ们зҶ”иһҚзҠ¶жҖҒдёӢйғҪиғҪеҜјз”ө |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж— иүІйҖҸжҳҺжә¶ж¶ІдёӯпјҢиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ(гҖҖгҖҖ) AпјҺMg2пјӢгҖҒNaпјӢгҖҒSO CпјҺCu2пјӢгҖҒNO |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺз”Ёе°ҸиӢҸжү“жІ»з–—иғғй…ёиҝҮеӨҡпјҡHCO BпјҺеҫҖзўій…ёй•Ғдёӯж»ҙеҠ зЁҖзӣҗй…ёпјҡCO CпјҺеҫҖжҫ„жё…зҹізҒ°ж°ҙдёӯйҖҡе…ҘиҝҮйҮҸдәҢж°§еҢ–зўіпјҡCa2пјӢпјӢ2OHпјҚпјӢCO2===CaCO3вҶ“пјӢH2O DпјҺж°ўж°§еҢ–й’Ўжә¶ж¶ІдёҺзЁҖзЎ«й…ёеҸҚеә”пјҡBa2пјӢпјӢSO |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗзҡ„жЈҖйӘҢж–№жі•еҗҲзҗҶзҡ„жҳҜ(гҖҖгҖҖ) AпјҺеҗ‘жҹҗжә¶ж¶Ідёӯж»ҙе…ҘKSCNжә¶ж¶Іе‘ҲзәўиүІпјҢиҜҙжҳҺдёҚеҗ«Fe2пјӢ BпјҺеҗ‘жҹҗжә¶ж¶ІдёӯйҖҡе…ҘCl2пјҢ然еҗҺеҶҚеҠ е…ҘKSCNжә¶ж¶ІеҸҳзәўиүІпјҢиҜҙжҳҺеҺҹжә¶ж¶Ідёӯеҗ«жңүFe2пјӢ CпјҺеҗ‘жҹҗжә¶ж¶ІдёӯеҠ е…ҘNaOHжә¶ж¶ІпјҢеҫ—зәўиӨҗиүІжІүж·ҖпјҢиҜҙжҳҺжә¶ж¶Ідёӯеҗ«жңүFe3пјӢ DпјҺеҗ‘жҹҗжә¶ж¶ІдёӯеҠ е…ҘNaOHжә¶ж¶Іеҫ—зҷҪиүІжІүж·ҖпјҢеҸҲи§ӮеҜҹеҲ°йўңиүІйҖҗжёҗеҸҳдёәзәўиӨҗиүІиҜҙжҳҺиҜҘжә¶ж¶ІдёӯеҸӘеҗ«жңү Fe2пјӢпјҢдёҚеҗ«жңүMg2пјӢ |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡв‘ N2пјӢ3H2===2NH3гҖҖв‘Ў3Cl2пјӢ8NH3===N2пјӢ6NH4ClпјӣеҲӨж–ӯдёӢеҲ—зү©иҙЁзҡ„иҝҳеҺҹжҖ§д»ҺејәеҲ°ејұзҡ„йЎәеәҸжҳҜ(гҖҖгҖҖ) AпјҺNH4Cl>NH3>H2В В В В BпјҺH2>NH3>NH4ClВ В В В CпјҺNH3>NH4Cl>H2В В В В В DпјҺH2>NH4Cl>NH3 |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ3Cl2пјӢ6KOH AпјҺCl2жҳҜж°§еҢ–еүӮпјҢKOHжҳҜиҝҳеҺҹеүӮ BпјҺKClжҳҜиҝҳеҺҹдә§зү©пјҢKClO3жҳҜж°§еҢ–дә§зү© CпјҺеҸҚеә”дёӯжҜҸж¶ҲиҖ—3 mol Cl2пјҢиҪ¬з§»з”өеӯҗж•°дёә5NA DпјҺиў«иҝҳеҺҹзҡ„ж°Ҝж°”зҡ„зү©иҙЁзҡ„йҮҸжҳҜиў«ж°§еҢ–зҡ„ж°Ҝж°”зҡ„зү©иҙЁзҡ„йҮҸзҡ„5еҖҚ |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
ж°ўеҢ–й’ (NaH)жҳҜдёҖз§Қз”ҹж°ўеүӮпјҢеҸҜеҸ‘з”ҹеҸҚеә”NaHпјӢH2O===NaOHпјӢH2вҶ‘пјҢеҜ№иҝҷдёҖеҸҚеә”зҡ„жҸҸиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺNaHжҳҜж°§еҢ–еүӮВ В В В В В В В В В В В В В В В В В В BпјҺз”ҹжҲҗ1 mol H2иҪ¬з§»2 mol з”өеӯҗ CпјҺNaOHжҳҜиҝҳеҺҹдә§зү©В В В В В В В В В В В В В В В В DпјҺж°§еҢ–дә§зү©е’ҢиҝҳеҺҹдә§зү©зҡ„иҙЁйҮҸжҜ”жҳҜ1вҲ¶1 |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
0.1 mol Al2(SO4)3и·ҹ350 mL 2 molВ·LпјҚ1зҡ„NaOHжә¶ж¶Іж··еҗҲпјҢжүҖеҫ—жІүж·Җзҡ„иҙЁйҮҸдёә(гҖҖгҖҖ) AпјҺ78 gВ В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺ15.6 gВ CпјҺ7.8 gВ В В В В В В В В В В В В В В В В В В В В В В В В DпјҺ3.9 g |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ІгҖҒд№ҷдёӨзғ§жқҜдёӯеҗ„зӣӣжңү100 mL 3 molВ·LпјҚ1зҡ„зӣҗй…ёе’ҢNaOHжә¶ж¶ІпјҢеҗ‘дёӨзғ§жқҜдёӯеҲҶеҲ«еҠ е…ҘзӯүиҙЁйҮҸзҡ„й“қзІүпјҢеҸҚеә”з»“жқҹеҗҺпјҢжөӢеҫ—з”ҹжҲҗзҡ„ж°”дҪ“дҪ“з§ҜжҜ”дёәз”ІвҲ¶д№ҷпјқ1вҲ¶2пјҢеҲҷеҠ е…Ҙй“қзІүиҙЁйҮҸдёәВ В В В В В В В В В В В В В В В В В В (гҖҖгҖҖ) AпјҺ5.4 gВ В В В В В В В В В В В В В В В В В В В В В В BпјҺ3.6 g CпјҺ2.7 gВ В В В В В В В В В В В В В В В В В В В В В В DпјҺ1.8 g |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
2.1 gе№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә7.2зҡ„COе’ҢH2з»„жҲҗзҡ„ж··еҗҲж°”дҪ“еңЁи¶ійҮҸзҡ„O2дёӯе……еҲҶзҮғзғ§еҗҺпјҢз«ӢеҚійҖҡе…Ҙи¶ійҮҸзҡ„Na2O2еӣәдҪ“дёӯпјҢе……еҲҶеҸҚеә”еҗҺеӣәдҪ“еўһеҠ зҡ„иҙЁйҮҸдёә(гҖҖгҖҖ) AпјҺ2.1 gВ В В В В В В В В В В В В В В В В В В В В В В BпјҺ3.6 g CпјҺ7.2 gВ В В В В В В В В В В В В В В В В В В В В В В DпјҺж— жі•зЎ®е®ҡ |
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠa gй“Ғй“қеҗҲйҮ‘зІүжң«жә¶дәҺи¶ійҮҸзӣҗй…ёдёӯпјҢеҠ е…ҘиҝҮйҮҸNaOHжә¶ж¶ІгҖӮиҝҮж»ӨеҮәжІүж·ҖпјҢз»Ҹжҙ—ж¶ӨгҖҒе№ІзҮҘгҖҒзҒјзғ§пјҢеҫ—еҲ°зәўиүІзІүжң«зҡ„иҙЁйҮҸд»Қдёәa gпјҢеҲҷеҺҹеҗҲйҮ‘дёӯй“Ғзҡ„иҙЁйҮҸеҲҶж•°дёә(гҖҖгҖҖ) AпјҺ70%В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺ52.4% CпјҺ47.6%В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺ30% |
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеңЁ25 в„ғгҖҒ1.01Г—105Paзҡ„жқЎд»¶дёӢпјҢ2.24 L H2дёӯеҗ«жңүзҡ„еҲҶеӯҗж•°е°ҸдәҺ0.1NA BпјҺ1 L 1 molВ·LпјҚ1зҡ„CaCl2жә¶ж¶Ідёӯеҗ«ClпјҚзҡ„ж•°зӣ®дёәNA CпјҺеңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 L H2Oзҡ„иҙЁйҮҸзәҰдёә18 g DпјҺ22 g CO2дёҺж ҮеҮҶзҠ¶еҶөдёӢ11.2 L H2Oеҗ«жңүзӣёеҗҢзҡ„еҲҶеӯҗж•° |
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
жҠҠ4.6 gй’ ж”ҫе…Ҙ200 mL 0.1 molВ·LпјҚ1 AlCl3жә¶ж¶ІдёӯпјҢеҫ…е…¶е……еҲҶеҸҚеә”еҗҺпјҢдёӢеҲ—еҸҷиҝ°дёӯй”ҷиҜҜзҡ„жҳҜВ В В В В В В В В В (гҖҖгҖҖ) AпјҺClпјҚзҡ„жө“еәҰеҮ д№ҺдёҚеҸҳВ В В В В В В В В В В В В В BпјҺжә¶ж¶ІеҸҳжө‘жөҠ CпјҺжә¶ж¶ІдёӯAl3пјӢе…ЁйғЁиҪ¬еҢ–дёәAlO |
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҗҢжё©гҖҒеҗҢеҺӢжқЎд»¶дёӢпјҢдёӨз§Қзү©иҙЁзҡ„йҮҸзӣёеҗҢзҡ„еҚ•иҙЁж°”дҪ“д№Ӣй—ҙзҡ„е…ізі»В В В В В В В В В В В В В (гҖҖгҖҖ) в‘ дҪ“з§ҜйғҪжҳҜ22.4 LВ в‘Ўе…·жңүзӣёеҗҢзҡ„дҪ“з§ҜВ В В в‘ўйғҪжҳҜеҸҢеҺҹеӯҗеҲҶеӯҗВ в‘Је…·жңүзӣёеҗҢзҡ„еҲҶеӯҗж•°зӣ® AпјҺв‘ в‘ўВ В В В В В В В BпјҺв‘Ўв‘ЈВ В В В В В В В В В CпјҺв‘ в‘ЈВ В В В В В В В В В В DпјҺв‘ўв‘Ј |
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
еЎ«еҶҷдёӢеҲ—з©әзҷҪпјҡ В (1)еҗ«жңү6.02Г—1023дёӘHзҡ„H2OпјҢе…¶зү©иҙЁзҡ„йҮҸжҳҜ_______пјӣ1 mol Na2SO4жә¶дәҺж°ҙиғҪз”өзҰ»еҮә______дёӘNaпјӢгҖӮ (2)______mol H2Oдёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёҺ1.5 mol CO2дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣёзӯүгҖӮ (3)е°Ҷзӯүзү©иҙЁзҡ„йҮҸзҡ„NH3е’ҢCH4ж··еҗҲпјҢж··еҗҲж°”дҪ“дёӯNH3дёҺCH4зҡ„иҙЁйҮҸжҜ”дёә________гҖӮ (4)ж ҮеҮҶзҠ¶еҶөдёӢпјҢеҜҶеәҰдёә0.75 gВ·LпјҚ1зҡ„NH3дёҺCH4з»„жҲҗзҡ„ж··еҗҲж°”дҪ“дёӯпјҢNH3зҡ„дҪ“з§ҜеҲҶж•°дёә__________пјҢиҜҘж··еҗҲж°”дҪ“еҜ№ж°ўж°”зҡ„зӣёеҜ№еҜҶеәҰдёә________гҖӮ (5)е·ІзҹҘa g Aе’Ңb g BжҒ°еҘҪе®Ңе…ЁеҸҚеә”з”ҹжҲҗ0.2 mol Cе’Ңd g DпјҢеҲҷCзҡ„ж‘©е°”иҙЁйҮҸдёә____________гҖӮ |
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
иҜ•еЎ«еҶҷд»ҘдёӢз©әзҷҪпјҡ (1)еҗҲйҮ‘Aз”ұ________е’Ң________з»„жҲҗгҖӮ (2)еҶҷеҮәдёӢеҲ—еҸҳеҢ–зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ CвҶ’E______________________________гҖӮ DвҶ’F___________________________В В В ___гҖӮ |
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
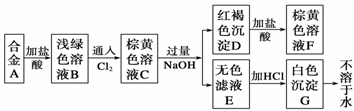
жңү4з§Қй’ зҡ„еҢ–еҗҲзү©WгҖҒXгҖҒYгҖҒZпјҢе®ғ们д№Ӣй—ҙеӯҳеңЁеҰӮдёӢе…ізі»пјҡ в‘ W в‘ўZпјӢH2OвҖ”вҶ’YпјӢO2вҶ‘В В В В В В В В В В в‘ЈXпјӢCa(OH)2вҖ”вҶ’YпјӢCaCO3вҶ“ иҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)WгҖҒXгҖҒYгҖҒZзҡ„еҢ–еӯҰејҸеҲҶеҲ«жҳҜWпјҡ________гҖҒXпјҡ________гҖҒYпјҡ________гҖҒZ________гҖӮ (2)д»ҘдёҠ4дёӘеҢ–еӯҰеҸҚеә”пјҢеұһдәҺж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жҳҜ______________(еЎ«еҸҚеә”еәҸеҸ·)пјҢеҸҚеә”дёӯж°§еҢ–еүӮжҳҜ__________(еҶҷеҢ–еӯҰејҸ)пјҢиҝҳеҺҹеүӮжҳҜ____________(еҶҷеҢ–еӯҰејҸ)гҖӮ (3)иӢҘв‘ЈеҸҚеә”еңЁжә¶ж¶ІдёӯиҝӣиЎҢпјҢеҶҷеҮәе…¶зҰ»еӯҗж–№зЁӢејҸд»ҘеҸҠиғҪз”ЁиҜҘзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәзҡ„еҸҰдёҖдёӘеҢ–еӯҰеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ в‘ зҰ»еӯҗж–№зЁӢејҸпјҡ________________________________________________________гҖӮ в‘ЎеҢ–еӯҰж–№зЁӢејҸпјҡ___________________________________________________________гҖӮ |
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
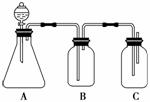
(1)иӢҘй”ҘеҪўз“¶дёӯиЈ…жңүжҹҗеҸҜжә¶жҖ§жӯЈзӣҗжә¶ж¶ІпјҢеҲҶж¶ІжјҸж–—дёӯжүҖзӣӣиҜ•еүӮеә”дёә__________гҖӮ (2)иЈ…зҪ®BжүҖзӣӣзҡ„иҜ•еүӮжҳҜ____________________пјҢе…¶дҪңз”ЁжҳҜ_________гҖӮ (3)иЈ…зҪ®CжүҖзӣӣиҜ•еүӮжҳҜ____________пјҢCдёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ___________гҖӮ (4)з”ұжӯӨеҫ—еҮәзҡ„з»“и®әжҳҜпјҡй…ёжҖ§пјҡ__________>__________>__________гҖӮ |
|
- 2018-2019е№ҙй«ҳдёҖеҗҺеҚҠжңҹжңҹжң«и°ғз ”еҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиӢҸзңҒеҰӮзҡӢеёӮпјү
- жіёе·һеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- дёҠжө·еёӮй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2020е№ҙй«ҳдёүдёӢеҶҢеҢ–еӯҰдё“йўҳз»ғд№ еёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- еҚ—е……еёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ йўҳе…Қиҙ№иҜ•еҚ·
- дё“йўҳ3.1 йҮ‘еұһеҸҠе…¶еҢ–еҗҲзү©пјҲз–‘йҡҫзӘҒз ҙпјү--е·…еі°еҶІеҲәй«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- жЈ ж№–дёӯеӯҰ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2019-2020е№ҙй«ҳдәҢдёӢеҚҠжңҹ4жңҲиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲжұҹиҘҝзңҒйғҪжҳҢеҺҝ第дёүдёӯеӯҰпјү