2019安徽高一下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
硒(Se)是人体必需的微量元素,具有抗氧化、增强免疫力等作用,下列说法错误的是( ) A. C.
|
|
| 2. | 详细信息 |
|
下列含有共价键的离子化合物是( ) A. Al2O3 B. NH3·H2O C. CH3COONa D. Na2O
|
|
| 3. | 详细信息 |
|
下列属于吸热反应的是( ) A. 氧化钙与水反应 B. 铁丝在氧气中燃 C.NaOH溶液与盐酸反应 D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
|
|
| 4. | 详细信息 |
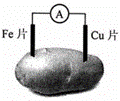
|
下图是土豆电池的示意图。土豆电池工作时,下列有关说法正确的是( ) A. Fe作负极,电极反应式为: Fe-3e-=Fe3+ B. Cu作正极,Cu片质量减少 C. 电子由Fe经导线流向Cu片 D. 实现了电能向化学能的转化
|
|
| 5. | 详细信息 |
|
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( ) A. 铅蓄电池放电时,负极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O B. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=Cu C. 生铁中含碳,抗腐蚀能力比纯铁强 D. 铁制品上镀锌,锌做阴极,铁制品做阳极,电解质溶液中含Zn2+
|
|
| 6. | 详细信息 |
|
下列离子方程式与所述事实相符且正确的是( ) A. NaHS水解反应:HS-+H2O B. Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O C. 过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3- D. Na2CO3水溶液中存在平衡:CO32-+H2O
|
|
| 7. | 详细信息 |
|
已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是( ) A. AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 B. AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L C. 将0.001mol/LAgNO3溶液滴入0.001 mol/L的KCl溶液中,无沉淀析出 D. 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KZsp(AgCl)< Ksp(AgBr)
|
|
| 8. | 详细信息 | ||||||||||||||||||||
|
下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是( )
|
|||||||||||||||||||||
| 9. | 详细信息 |
|
下列叙述中,不能用平衡移动原理解释的是( ) A. 用排饱和食盐水的方法收集氯气 B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率 C. 溴水中有下列平衡Br2+H2O D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
|
|
| 10. | 详细信息 |
|
向某容积一定的密闭容器中充入2molSO2和1molO2,一定条件下发生如下反应:2SO2+O2 A. 升高温度或充入一定量O2均能加快化学反应速率 B. 达到平衡状态时,SO2、O2、SO3物质的量之比一定为2:1:2 C. 当SO2的生成速率与SO3的生成速率相等时,反应达到平衡状态 D. 达到平衡状态时,生成SO3的物质的量一定小于2mol
|
|
| 11. | 详细信息 |
|
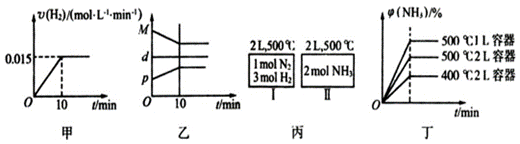
合成氨化学方程式 N2(g)+3H2(g)
A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示 B. 反应过程中,混合气体平均相对分子质最M,混合气体密度d,混合气体压强p,三者关系如图乙所示 C. 图丙容器I和II达到平衡时,NH3的体积分数 D. 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
|
|
| 12. | 详细信息 |
|
氧化亚铜常用于制船底防污漆。用CuO与Cu高温烧结可制取Cu2O已知反应: 2Cu(s)+O2(g)=2CuO(s),ΔH=-314kJ/mol2Cu2O(s)+O2(g)=4CuO(s),ΔH=-292kJ/mol则CuO(s)+Cu(s)=Cu2O(s)的ΔH等于( ) A. -11kJ/mol B. +11kJ/mol C. +22kJ/mol D. -22kJ/mol
|
|
| 13. | 详细信息 |
|
500mLKNO3和Cu(NO3)2的混合溶液中c( A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移6 mol电子 C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
|
|
| 14. | 详细信息 |
|
室温下,设 1L pH=6 的 AlCl3溶液中,由水电离出的 H+物质的量为n1;1L pH=6 的 HCl 溶液中,由水电离出的 H+物质的量为 n2.则 n1/n2的值是( ) A. 0.01 B. 1 C. 10 D. 100
|
|
| 15. | 详细信息 |
|
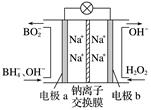
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
A.电池放电时Na+从b极区移向a极区 B.电极b采用MnO2,MnO2既作电极材料又有催化作用 C.每消耗1 mol H2O2,转移的电子为1 mol D.该电池的正极反应为
|
|
| 16. | 详细信息 |
|
已知 Na2SO3和 KIO3 反应过程和机理较复杂,一般认为分以下①~④步反应。 ②IO2-+2SO32-=I-+2SO42-(反应速率快) ③5I-+IO3-+6H+=3I2+3H2O(反应速率快) ④I2+SO32-+H2O=2I-+SO42-+2H+(反应速率快) 下列说法不正确的是( ) A. IO2-和 I-是该反应的催化剂 B. 此反应总反应速率由反应①决定 C. 此反应①中氧化剂是IO3-,反应③中还原剂是 I- D. 若生成 0.5mol 碘单质,则总反应中有 5mol 电子转移
|
|
| 17. | 详细信息 |
|
常温下,下列关于溶液中粒子浓度大小关系的说法正确的是( ) A. 0.1mol/LNa2CO3 溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) B. 0.1mol/L的NH4Cl溶液和0.1mol/L的NH3·H2O溶液等体积混合后的溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) C. 醋酸钠溶液中滴加醋酸溶液,则混合溶液一定有:c(Na+)<c(CH3COO-) D. 0.1 mol/L NaHS 的溶液中: c(OH-)+ c(S2-)= c(H+)+c(H2S)
|
|
| 18. | 详细信息 |
|
pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是( )
A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6 C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1% D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
|
|
| 19. | 详细信息 |
|
A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。 (1)A2W的电子式为________。 (2)B中质子数和中子数相等的核素符号为______ ,E元素在周期表中的位置为____________。(3)W、D、E三种元素的简单离子半径由小到大的顺序为_________________ ( 填离子符号)。 (4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为______________________________________________________________ ,若将 1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是______ L(标准 状况下)。 (5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。 a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱 b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强 c. 比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
|
|
| 20. | 详细信息 |
|
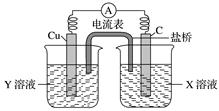
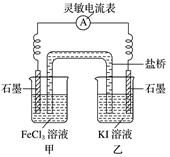
(1)利用反应Cu+2FeCl3===CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
①写出正极电极反应式: ________________________________________________________________________。 ②图中X溶液是___________,原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方向移动。 (2)控制适合的条件,将反应2Fe3++2I-
请回答下列问题: ①反应开始时,乙中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为_________________________________________________。 ②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨电极上的反应式为___________________________________________。 (3)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_________________________________________________________。
|
|
| 21. | 详细信息 |
|
我国国标推荐的食品药品中Ca元素含量的测定方法之一:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题: (1)KMnO4溶液应该用________(填“酸式”或“碱式”)滴定管盛装。 (2)写出滴定过程中反应的离子方程式:____________________________________________。 (3)滴定终点的颜色变化:溶液由________色变为________色。 (4)以下哪些操作会导致测定的结果偏高________(填字母编号)。 a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数 c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出 (5)某同学对上述实验方法进行了改进并用于测定某品牌的钙片中的钙元素(主要为CaCO3)含量,其实验过程如下:取2.00 g样品加入锥形瓶中,用酸式滴定管向锥形瓶内加入20.00 mL浓度为0.10 mol·L-1的盐酸(盐酸过量),充分反应一段时间,用酒精灯将锥形瓶内液体加热至沸腾,数分钟后,冷却至室温,加入2~3滴酸碱指示剂,用浓度为0.10 mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液8.00 mL。[提示:Ca(OH)2微溶于水,pH较低时不会沉淀] ①为使现象明显、结果准确,滴定过程中的酸碱指示剂应选择________(填“石蕊”、“甲基橙”或“酚酞”)溶液; ②此2.00 g钙片中CaCO3的质量为________g。
|
|
| 22. | 详细信息 | ||||||||||||||
|
H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答: Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。 (1)该反应的化学方程式为______________________________________________________。 Ⅱ.H2S可用于检测和沉淀金属阳离子。 (2)H2S的第一步电离方程式为__________________________________________________。 (3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。 Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为 ⅰ.COS(g)+H2(g) ⅱ.CO(g)+H2O(g) (4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
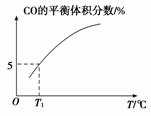
表中x=________。 (5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
①随着温度升高,CO的平衡体积分数________(填“增大”或“减小”)。原因为_______________________________________________________________________________ ______________________________________________________________________________。 ②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为________;反应ⅰ的平衡常数为________(保留两位有效数字)。
|
|||||||||||||||