2018高一上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
对中国古代著作涉及化学的叙述,下列解读错误的是( ) A. 《汉书
|
|
| 2. | 详细信息 | ||
|
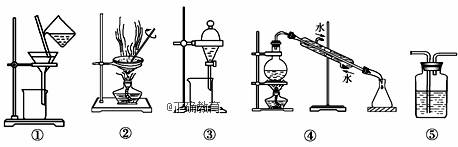
下列实验中,所选装置或实验设计合理的是( ) ① ② ③ ④ ⑤ A.用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体 B.用乙醇提取溴水中的溴选择图③所示装置 C.用图④所示装置可以分离乙醇水溶液 D.图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
|
|||
| 3. | 详细信息 |
|
下列事实与胶体性质无关的是 ( ) A.在豆浆里加入盐卤做豆腐 B.在河流入海处易形成沙洲 C.一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路 D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
|
|
| 4. | 详细信息 |
|
用容量瓶配制一定物质的量浓度的 A. 在用天平称量时,托盘里的部分
|
|
| 5. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,2.24 L H2和O2的混合气体中分子数为0.2 NA B.1L 0.1 mol·L-1碳酸钠溶液中含有的氧原子数为0.3 NA C.14g N2 和CO的混合气体中分子数为0.5 NA D.1L 0.1 mol·L-1盐酸中含有HCl分子数为0.1 NA
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) A.将CaCO3放入水中不溶解,故CaCO3不是电解质 B.SO2溶于水得到的溶液能导电,故SO2是电解质 C.电解质发生电离需要通电才能进行 D.K2O固体不导电,但熔融的K2O能导电,所以K2O是电解质
|
|
| 7. | 详细信息 |
|
有一份气体样品的质量是ag,体积是b L(标准状况下),该cg该气体所含有的分子数为(NA为阿伏加德罗常数)( ) A.bcNA/22.4a B.aNA/22.4bc C.abNA/22.4c D.bNA/22.4ac
|
|
| 8. | 详细信息 |
|
下列有关物质的分类正确的是( ) A.氯化钡、四氯化碳、硫酸、碘酒都属于化合物 B.硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱,盐、氧化物 C.溶液、浊液、胶体、空气都属于混合物 D. CO2、S02、P2O5、CO都属于酸性氧化物
|
|
| 9. | 详细信息 |
|
下列离子检验的方法正确的是( ) A.某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中一定含有C1- B.溶液先加足量盐酸无现象,再滴加BaC12溶液有白色沉淀,则原溶液中一定含有SO42- C.某无色溶液滴如酚酞显红色,该溶液中一定含有大量的H+ D.某溶液中滴加稀硫酸生成无色气体,说明原溶液中一定含有CO32-
|
|
| 10. | 详细信息 |
|
在碱性溶液中能大量共存且溶液为无色透明的一组离子是 A.
|
|
| 11. | 详细信息 |
|
根据反应:①Fe+Cu2+═Fe2++Cu ②Fe3++Cu═Cu2++2Fe2+ ③2Fe2++Cl2═2Fe3++2Cl﹣ ④HClO+H++Cl﹣═Cl2+H2O 可以判断出各微粒的氧化性由强到弱的顺序正确的是( ) A.Cl2>HClO>Fe3+>Cu2+>Fe2+ B. HClO>Cl2>Fe3+>Cu2+>Fe2+ C.Cl2>Fe3+>HClO>Cu2+>Fe2+ D.HClO>Cl2>Cu2+>Fe3+>Fe2+.
|
|
| 12. | 详细信息 |
|
下列变化中,需要加入氧化剂才能实现的是 A.
|
|
| 13. | 详细信息 |
|
A.NH4Cl溶液与NaOH溶液混合 B.H2SO4溶液与Ba(OH) 2溶液混合 C.NaHCO3溶液与KOH溶液混合 D.NaHSO4溶液与NaOH溶液混合
|
|
| 14. | 详细信息 |
|
下列离子方程式正确的是( ) A.铁与稀硫酸反应:2Fe+6H+ = 2Fe3++3H2↑ B.用氢氧化钠溶液吸收过量二氧化碳气体:CO2 + OH- = HCO3- + H2O C.碳酸氢钠溶液和过量的澄清石灰水混合:HCO3-+ Ca2+ + OH-= CaCO3↓ + H2O D.醋酸除去水垢:2H+ + CaCO3 = Ca2+ + CO2↑+ H2O
|
|
| 15. | 详细信息 |
|
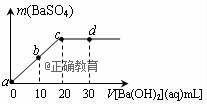
常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的( ) A.b处溶液的c(H+)与d处溶液的c(OH﹣)相等 B.a~d溶液的导电能力:a<b<c<d C.a~d溶液的C(H+):a>b>c>d D.c处溶液和d处溶液均呈碱性
|
|
| 16. | 详细信息 |
|
高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能作为净水的水处理剂。工业制备高铁酸钾的反应离子方程式为Fe(OH)3+C1O-+OH-→FeO42-+C1-+H2O(未配平)。下列有关说法不正确的是 A. 上述反应中氧化剂和还原剂的物质的量之比为3:2 B. 高铁酸钾中铁显+6价 C. 由上述反应可知,Fe(OH)3的氧化性强于FeO42- D. K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
|
|
| 17. | 详细信息 |
|
M2 A.+2 B.+4
|
|
| 18. | 详细信息 |
|
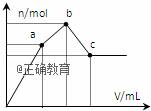
向100mL 0.1mol·L﹣1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L﹣1Ba(OH)2溶液. 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是(Al(OH)3+NaOH==NaAlO2+2H2O)( ) A.a点对应的沉淀只有BaSO4 B.c点溶液呈碱性 C.b点发生反应的离子方程式是:Al3++2SO42﹣+2Ba2++3OH﹣═Al(OH)3↓+2BaSO4↓ D.c点加入Ba(OH)2溶液的体积为200mL
|
|
| 19. | 详细信息 | |||||||||||||||
|
下列实验过程中对异常情况的原因分析,没有科学依据的是
A.
|
||||||||||||||||
| 20. | 详细信息 |
|
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验(已知: NH4++OH- (1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( ) A.Ba2+一定不存在,Mg2+可能存在 B. 100mL溶液中含0.01mol CO32- C. Cl-一定存在 D. K+一定存在,且100mL溶液中n(K+)≥0.02 mol
|
|
| 21. | 详细信息 |
|
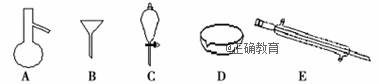
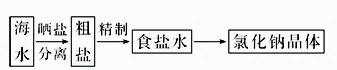
写出上述仪器的名称:A___________,C___________,E___________。
写出三种试剂的化学式:A____________,B________________,C________________。
粗盐中含 A. C.
|
|
| 22. | 详细信息 |
|
浓硫酸是常用的干燥剂,根据需要可将浓硫酸配成不同浓度的稀硫酸。回答下列问题: (1)1L 0.5mol/L的H2SO4溶液中含有H2SO4 g,含有H+ 个, 其电离方程式为 ,将此溶液与足量的铝片反应,反应的离子方程式为 。 (2)配制上述稀硫酸需要量取质量分数为98%,密度为1.84g/cm3的浓硫酸 mL (结果保留一位小数)。配制此溶液需要的玻璃仪器除了烧杯、玻璃棒、胶头滴管外还需要 。 (3)稀释浓硫酸的操作是 。 (4)下列操作使配制的硫酸溶液的物质的量浓度偏小的是 。 A.稀释浓硫酸时有液体溅出 B.容量瓶中有少量蒸馏水残留 C.浓硫酸稀释后溶液没有冷却到室温就转移 D.向容量瓶加水定容时仰视刻度线
|
|
| 23. | 详细信息 |
|
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:
|
|
| 24. | 详细信息 |
|
现有一包白色粉末,初步确定其成分可能是NaCl与Na2CO3中的一种或两种。小明、小军、小红分别做了下面的实验。 (1)小明取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有 (写化学式),生成气体的离子方程式为: (2)小军将白色粉末溶解于水后加入AgNO3溶液,产生白色沉淀,则证明有NaCl,你认为小军的这个方案是否严密? (填写“严密”或“不严密”)。 (3)为探究白色粉末是否含有NaCl,小红也设计了实验方案,操作如下:
①写出生成白色沉淀的离子方程式 ②小军认为小红的这个方案也有问题,理由是 ;小军认为只要将其中一种试剂改为 (填化学式)稀溶液,就可以证明有NaCl存在。
|
|