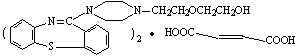2018жөҷжұҹй«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰеҗҢжӯҘз»ғд№
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еұһдәҺй…ёжҖ§ж°§еҢ–зү©зҡ„жҳҜ AпјҺCO2В В В В В В В В В BпјҺKOHВ В В В В В В В В В В В В CпјҺHNO3В В В В В В В В DпјҺNa2SO4В В В
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ӘеҷЁеҗҚз§°дёәвҖңе®№йҮҸ瓶вҖқзҡ„жҳҜ AпјҺ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеұһдәҺз”өи§ЈиҙЁдё”иғҪеҜјз”өзҡ„жҳҜ AпјҺй…’зІҫВ В В В В BпјҺйҮ‘еұһй“ңВ В В В В В В В CпјҺж¶ІжҖҒж°ҜеҢ–ж°ўВ В В В В В DпјҺзҶ”иһҚж°ҜеҢ–й’ҫ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҸҚеә”CпјӢ2H2SO4(жө“) В AпјҺй…ёжҖ§В В В В В В В BпјҺејәж°§еҢ–жҖ§ В В CпјҺй…ёжҖ§е’Ңејәж°§еҢ–жҖ§В В В В В В В DпјҺиҝҳеҺҹжҖ§
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„ж°ҙжә¶ж¶ІдёӯпјҢеӣ ж°ҙи§Је‘Ҳй…ёжҖ§зҡ„жҳҜ AпјҺCO2В В В В В В В В В В BпјҺNaHSO4В В В В В В В В В В В В CпјҺHClВ В В В В В В DпјҺFe2(SO4) 3
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺиҒҡд№ҷзғҜжҳҜдёҖз§Қе№ҝеҸ‘з”ЁдәҺеҲ¶йҖ ж°ҙжқҜгҖҒеҘ¶з“¶гҖҒйЈҹзү©дҝқйІңиҶңзӯүз”Ёе“Ғзҡ„жңүжңәй«ҳеҲҶеӯҗжқҗж–ҷВ В В В В В В BпјҺе·ҘдёҡдёҠз”Ёз„ҰзӮӯеңЁй«ҳжё©дёӢиҝҳеҺҹдәҢж°§еҢ–зЎ…еҸҜеҲ¶еҫ—зәҜзЎ…В В CпјҺжө·ж°ҙдёӯжәҙзҰ»еӯҗжө“еәҰеӨ§пјҢеӣ жӯӨжәҙиў«з§°дёәвҖңжө·жҙӢе…ғзҙ вҖқВ В В В В В В В В В В В В В В DпјҺз”ЁдәҺз”өж°”е·Ҙдёҡзҡ„зәҜй“ңеҸҜз”ұй»„й“ҒзҹҝеҶ¶зӮјзӣҙжҺҘеҫ—еҲ°
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯиЎЁиҝ°жӯЈзЎ®зҡ„жҳҜ AпјҺз”ҳж°Ёй…ёзҡ„з»“жһ„з®ҖејҸпјҡH2NCH2COOHВ В В В В В В В В BпјҺHClзҡ„з”өеӯҗејҸ CпјҺж°ҜзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AпјҺз¬ҰеҗҲйҖҡејҸCnH2n+2дё”nдёҚеҗҢзҡ„зғғдёҖе®ҡеұһдәҺеҗҢзі»зү©В В В В В В В В В В В BпјҺC60е’Ңзәізұізўіз®Ўдә’дёәеҗҢзҙ ејӮеҪўдҪ“ CпјҺе®Үе®ҷе°„зәҝзҡ„дҪңз”ЁдёӢеҸҜдҪҝ14NиҪ¬еҢ–дёә14C,14Nе’Ң14Cдә’дёәеҗҢдҪҚзҙ В В В В В В В В В В В В DпјҺC5H12зҡ„жҹҗз§ҚеҗҢеҲҶејӮжһ„дҪ“еҸӘжңүдёҖз§ҚдёҖж°Ҝд»Јзү©
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺзҹіжІ№зҡ„и’ёйҰҸе®һйӘҢдёӯпјҢеҝҳи®°еҠ жІёзҹіпјҢеә”з«ӢеҚіи¶ҒзғӯеҠ е…ҘжІёзҹіпјҢд»Ҙе…ҚжҡҙжІё BпјҺдҝқеӯҳж°ҜеҢ–дәҡй“Ғжә¶ж¶Іж—¶пјҢеә”еҠ е°‘йҮҸй“ҒзІү CпјҺеҗ‘й“ңдёҺжө“зЎ«й…ёеҸҚеә”еҗҺзҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ ж°ҙпјҢеҲӨж–ӯжңүж— й“ңзҰ»еӯҗ DпјҺдәҢж°§еҢ–зЎ«иғҪдҪҝж»ҙжңүй…ҡй…һзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІиӨӘиүІпјҢдҪ“зҺ°дәҶе…¶жјӮзҷҪжҖ§
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁзЎ«й…ёе·Ҙдёҡз”ҹдә§дёӯпјҢдёәдәҶжңүеҲ©дәҺSO2зҡ„иҪ¬еҢ–пјҢдё”иғҪе……еҲҶеҲ©з”ЁзғӯиғҪпјҢйҮҮз”ЁдәҶдёӯй—ҙжңүзғӯдәӨжҚўеҷЁзҡ„жҺҘи§Ұе®ӨпјҲи§ҒеҸіеӣҫпјүгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ A.aгҖҒbдёӨеӨ„зҡ„ж··еҗҲж°”дҪ“жҲҗеҲҶеҗ«йҮҸзӣёеҗҢпјҢжё©еәҰдёҚеҗҢ B.cгҖҒdдёӨеӨ„зҡ„ж··еҗҲж°”дҪ“жҲҗеҲҶеҗ«йҮҸзӣёеҗҢпјҢжё©еәҰдёҚеҗҢ C.зғӯдәӨжҚўеҷЁзҡ„дҪңз”ЁжҳҜйў„зғӯеҫ…еҸҚеә”зҡ„ж°”дҪ“пјҢеҶ·еҚҙеҸҚеә”еҗҺзҡ„ж°”дҪ“ D.cеӨ„ж°”дҪ“з»ҸзғӯдәӨжҚўеҗҺеҶҚж¬ЎеӮ¬еҢ–ж°§еҢ–зҡ„зӣ®зҡ„жҳҜжҸҗй«ҳSO2зҡ„иҪ¬еҢ–зҺҮ |
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёҖе®ҡжқЎд»¶дёӢпјҢ3molXдёҺ3molYеңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”X(g)+3Y(g) BпјҺеҸҚеә”дёҖж®өж—¶й—ҙеҗҺпјҢXдёҺYзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”и®Өдёә1:1 CпјҺXзҡ„дҪ“з§ҜеҲҶж•°дёҚеҸҳпјҢиҜҙжҳҺеҸҚеә”е·ІиҫҫеҲ°е№іиЎЎзҠ¶жҖҒ DпјҺиҫҫеҲ°е№іиЎЎеҗҺпјҢиӢҘеҗ‘е№іиЎЎдҪ“зі»дёӯе……е…Ҙж°Ұж°”пјҢZзҡ„еҸҚеә”йҖҹзҺҮдёҚеҸҳ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ AпјҺж°Ҝзўұе·Ҙдёҡдёӯз”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙпјҡ2Clп№Ј+2H2O BпјҺж°ҜеҢ–й“Ғжә¶ж¶Іи…җиҡҖй“ңжқҝпјҡFe3++Cu=Fe2++Cu2+ CпјҺж°ўж°§еҢ–й’ жә¶ж¶Іеҗёж”¶е°‘йҮҸдәҢж°§еҢ–зЎ«SO2+OHп№Ј=HSO3п№Ј DпјҺзЁҖзЎ«й…ёдёӯеҠ ж°ўж°§еҢ–й’Ўжә¶ж¶ІиҮідёӯжҖ§пјҡBa2++H++OHп№Ј+SO42п№Ј=BaSO4вҶ“+H2O
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
aгҖҒbгҖҒcгҖҒd дёәеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ пјҢa еҺҹеӯҗж ёеӨ–з”өеӯҗжҖ»ж•°дёҺ b еҺҹеӯҗж¬ЎеӨ–еұӮзҡ„з”өеӯҗж•°зӣёеҗҢпјӣc жүҖеңЁе‘Ёжңҹж•°дёҺж—Ҹж•°зӣёеҗҢпјӣd дёҺ a еҗҢж—ҸпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ AпјҺеҺҹеӯҗеҚҠеҫ„пјҡdпјһcпјһbпјһaВ В В В В В В В В В В В В В В В В В BпјҺ4 з§Қе…ғзҙ дёӯ b зҡ„йҮ‘еұһжҖ§жңҖејә CпјҺc зҡ„ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©жҳҜејәзўұ В В В В В В В В В В В В В DпјҺd еҚ•иҙЁзҡ„ж°§еҢ–жҖ§жҜ” a еҚ•иҙЁзҡ„ж°§еҢ–жҖ§ејә
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺд№ҷзӮ”дёҺиӢҜд»Ҙд»»ж„ҸжҜ”ж··еҗҲпјҢеҸӘиҰҒж··еҗҲзү©жҖ»иҙЁйҮҸдёҖе®ҡпјҢе®Ңе…ЁзҮғзғ§з”ҹжҲҗзҡ„CO2зҡ„жҖ»йҮҸдјҡеҸҳеҢ–В В В В В В BпјҺж·ҖзІүе’ҢзәӨз»ҙзҙ дә’дёәеҗҢеҲҶејӮжһ„дҪ“ CпјҺеҲҶйҰҸжұҪжІ№иғҪдҪҝжәҙзҡ„еӣӣж°ҜеҢ–зўіжә¶ж¶ІиӨӘиүІВ В DпјҺзҹіжІ№иЈӮеҢ–е’ҢиЈӮи§Јзҡ„зӣ®зҡ„еқҮжҳҜдёәдәҶе°Ҷй•ҝй“ҫзғғиҪ¬еҢ–дёәзҹӯй“ҫзғғ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AпјҺжІ№и„ӮжҳҜй«ҳзә§и„ӮиӮӘй…ёз”ҳжІ№й…ҜпјҢеңЁзғӯзҡ„NaOHжә¶ж¶Ідёӯж°ҙи§ЈеҗҺж··еҗҲж¶ІдёҚеҲҶеұӮ B.еңЁзҙ«еӨ–зәҝгҖҒйҘұе’ҢзЎ«й…ёй“өжә¶ж¶ІгҖҒCuSO4жә¶ж¶Ізҡ„дҪңз”ЁдёӢпјҢиӣӢзҷҪиҙЁеҸ‘з”ҹеҸҳжҖ§ CпјҺйҶӢй…ёгҖҒи‘Ўиҗ„зі–е’Ңж·ҖзІүдёүз§Қж— иүІжә¶ж¶ІпјҢеҸҜд»Ҙз”Ёж–°еҲ¶Cu(OH)2жӮ¬жөҠж¶ІжЈҖйӘҢ DпјҺиӣӢзҷҪиҙЁдёӯйҷӨеҗ«жңүзўігҖҒж°ўгҖҒж°§еӨ–пјҢиҝҳеҗ«жңүж°®зӯүе…ғзҙ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺжҹҗз”өжұ д»ҘK2FeO4е’ҢZnдёәз”өжһҒжқҗж–ҷпјҢKOHжә¶ж¶Ідёәз”өи§ЈиҙЁжә¶ж¶ІгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺз”өжұ е·ҘдҪңж—¶ BпјҺжӯЈжһҒеҸҚеә”ејҸдёә2FeO42вҲ’+ 10H++6eвҲ’=Fe2O3+5H2O CпјҺиҜҘз”өжұ ж”ҫз”өиҝҮзЁӢдёӯз”өи§ЈиҙЁжә¶ж¶Іжө“еәҰдёҚеҸҳ DпјҺZnдёәз”өжұ зҡ„иҙҹжһҒ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—е…ідәҺз”өи§ЈиҙЁжә¶ж¶Ізҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В В В A.25в„ғж—¶пјҢжҹҗжө“еәҰзҡ„KHAжә¶ж¶ІpH=4,еҲҷ HA_зҡ„з”өзҰ»зЁӢеәҰеӨ§дәҺж°ҙи§ЈзЁӢеәҰпјҢH2Aдёәејұй…ё B.еёёжё©дёӢйҖҡиҝҮжөӢе®ҡ0.1mol/LNH4Clжә¶ж¶Ізҡ„й…ёзўұжҖ§иғҪиҜҒжҳҺдёҖж°ҙеҗҲж°ЁжҳҜејұз”өи§ЈиҙЁ C.еҗҢжө“еәҰзҡ„зӣҗй…ёе’ҢйҶӢй…ёзЁҖйҮҠзӣёеҗҢеҖҚж•°еҗҺпјҢзӣҗй…ёзҡ„pHеӨ§дәҺйҶӢй…ё D.0.2 molВ·LпјҚ1 CH3COOHжә¶ж¶Ідёӯзҡ„c(H+)жҳҜ0.1 molВ·LпјҚ1 HClжә¶ж¶Ідёӯзҡ„c(H+)зҡ„2еҖҚ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
ж №жҚ®дёӢеӣҫжүҖзӨәзҡ„иҝҮзЁӢдёӯзҡ„иғҪйҮҸеҸҳеҢ–жғ…еҶөпјҢеҲӨж–ӯдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺH2(g)иҪ¬еҢ–дёәж°ўеҺҹеӯҗжҳҜдёҖдёӘж”ҫзғӯиҝҮзЁӢ BпјҺ1molH2е’Ң1molCl2зҡ„жҖ»иғҪйҮҸжҜ”2molHClзҡ„жҖ»иғҪйҮҸдҪҺ CпјҺ1 дёӘ HCl(g)еҲҶеӯҗдёӯзҡ„еҢ–еӯҰй”®ж–ӯиЈӮж—¶йңҖиҰҒеҗёж”¶431.8 kJиғҪйҮҸ DпјҺ2HCl(g)= H2(g)+Cl2(g)зҡ„еҸҚеә”зғӯО”H=+184.5 kJВ·mol-1
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AпјҺCO2гҖҒSiO2зҡ„жҷ¶дҪ“з»“жһ„зұ»еһӢдёҚеҗҢ BпјҺеҠ зғӯзЎ…гҖҒзЎ«жҷ¶дҪ“дҪҝд№ӢзҶ”еҢ–пјҢе…ӢжңҚзҡ„дҪңз”ЁеҠӣдёҚеҗҢ CпјҺHClгҖҒNaClжә¶дәҺж°ҙпјҢз ҙеқҸзҡ„еҢ–еӯҰеҒҘзұ»еһӢзӣёеҗҢ DпјҺNaOHгҖҒNH4Clжҷ¶дҪ“дёӯж—ўжңүзҰ»еӯҗй”®еҸҲжңүе…ұд»·й”®
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
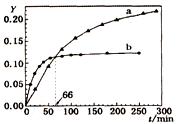
е·ұзҹҘеҸҚеә”пјҡ2A(l)
AпјҺaд»ЈиЎЁ20в„ғдёӢAзҡ„Y-tжӣІзәҝ BпјҺеҸҚеә”еҲ°66minж—¶пјҢ0в„ғе’Ң20в„ғдёӢеҸҚеә”ж”ҫеҮәзҡ„зғӯйҮҸзӣёзӯү CпјҺ0в„ғе’Ң20в„ғдёӢиҫҫеҲ°е№іиЎЎж—¶пјҢеҸҚеә”йғҪж”ҫеҮәQkJзғӯйҮҸ DпјҺеҸҚеә”йғҪиҫҫеҲ°е№іиЎЎеҗҺпјҢжӯЈеҸҚеә”йҖҹзҺҮa > b
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
йҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёә NAгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺ1 L 0.1 molВ·L-1 NH4 Cl жә¶ж¶ІдёӯпјҢNH4+зҡ„ж•°йҮҸдёә 0.1N A BпјҺ2.4 g Mg дёҺ H2SO4 е®Ңе…ЁеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°дёә 0.1NA CпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ2.24 L N2 е’Ң O2 зҡ„ж··еҗҲж°”дҪ“дёӯеҲҶеӯҗж•°дёә 0.2 NA DпјҺ0.1 mol H2 е’Ң 0.1 mol I2 дәҺеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺпјҢе…¶еҲҶеӯҗжҖ»ж•°дёә 0.2 NA
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
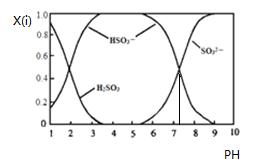
В еҗ«зЎ«еҗ„еҫ®зІ’пјҲH2SO3гҖҒHSO3-е’ҢSO32-пјүеӯҳеңЁдәҺSO2дёҺNaOHжә¶ж¶ІеҸҚеә”еҗҺзҡ„жә¶ж¶ІдёӯпјҢе®ғ们зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°XпјҲiпјүдёҺжә¶ж¶ІpHВ зҡ„е…ізі»еҰӮдёӢеӣҫжүҖзӨәпјҺдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ D.з”ұеӣҫдёӯж•°жҚ®еҸҜдј°з®—еҮәcпјҲH+пјүГ—cпјҲSO32-пјү/cпјҲH2SO3пјүдёә10-7.3
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ | |||
|
е®һйӘҢе®ӨеҸҜеҲ©з”ЁзЎ«й…ёеҺӮзӮүжёЈпјҲдё»иҰҒжҲҗеҲҶдёәй“Ғзҡ„ж°§еҢ–зү©еҸҠе°‘йҮҸFeSгҖҒSiO2зӯүпјүеҲ¶еӨҮиҒҡй“Ғе’Ңз»ҝзҹҫпјҲFeSO4вҖў7H2OпјүпјҢиҒҡй“Ғзҡ„еҢ–еӯҰејҸдёә[Fe2(OH)n(SO4)3п№Ј0.5n]mпјҢеҲ¶еӨҮиҝҮзЁӢеҰӮеӣҫжүҖзӨәпјҡдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
AпјҺзӮүжёЈдёӯFeSдёҺзЎ«й…ёе’Ңж°§ж°”зҡ„еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡ4FeS+3O2+12H+в•җ4Fe3++4SвҶ“+6H2O BпјҺж°”дҪ“Mзҡ„жҲҗеҲҶжҳҜSO2пјҢйҖҡе…ҘеҸҢж°§ж°ҙеҫ—еҲ°зЎ«й…ёпјҢеҸҜеҫӘзҺҜдҪҝз”Ё CпјҺжә¶ж¶ІZзҡ„pHеҪұе“ҚиҒҡй“Ғдёӯй“Ғзҡ„иҙЁйҮҸеҲҶж•°пјҢиӢҘе…¶pHеҒҸе°ҸпјҢе°ҶеҜјиҮҙиҒҡй“Ғдёӯй“Ғзҡ„иҙЁйҮҸеҲҶж•°еҒҸеӨ§ DпјҺеҗ‘жә¶ж¶ІXдёӯеҠ е…ҘиҝҮйҮҸй“ҒзІүпјҢе……еҲҶеҸҚеә”еҗҺиҝҮж»Өеҫ—еҲ°жә¶ж¶ІYпјҢеҶҚз»Ҹи’ёеҸ‘жө“зј©гҖҒеҶ·еҚҙз»“жҷ¶гҖҒиҝҮж»ӨзӯүжӯҘйӘӨеҫ—еҲ°з»ҝзҹҫ
|
||||
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІжә¶ж»ҡдёӯеҸҜиғҪеҗ«жңүNa+гҖҒNH4+гҖҒBa2+гҖҒCu2+гҖҒSO42п№ЈгҖҒSO32п№ЈгҖҒClп№ЈгҖҒBrп№ЈгҖҒCO32п№Јдёӯзҡ„иӢҘе№Із§ҚпјҺдёәжЈҖйӘҢе…¶дёӯеҗ«жңүзҡ„зҰ»еӯҗпјҢиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ в‘ еҸ–10mLжә¶ж¶ІпјҢеҠ е…Ҙи¶ійҮҸж°Ҝж°ҙпјҢпјҺж— ж°”дҪ“дә§з”ҹпјҢеҶҚеҠ е…ҘCCl4жә¶ж¶ІеҲҶеұӮпјҢдёӢеұӮдёәж©ҷзәўиүІпјӣ в‘ЎеҲҶж¶ІеҗҺпјҢе°Ҷв‘ дёӯдёҠеұӮжә¶ж¶ІеҠ е…Ҙи¶ійҮҸBaCl2е’ҢHClжә¶ж¶ІпјҢдә§з”ҹзҷҪиүІжІүж·Җ2.33gпјӣ в‘ўеҸҰеҸ–10mLеҺҹжә¶ж¶ІпјҢеҠ е…ҘиҝҮйҮҸзҡ„жө“ж°ўж°§еҢ–й’ жә¶ж¶Іе№¶еҠ зғӯпјҢ收йӣҶеҲ°ж ҮеҮҶзҠ¶еҶөдёӢ448mlж°”дҪ“пјҺдёӢеҲ—е…ідәҺеҺҹжә¶ж¶Ізҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺиӮҜе®ҡеӯҳеңЁNH4+гҖҒClп№ЈгҖҒBrп№Ј BпјҺSO42п№ЈгҖҒSO32п№ЈиҮіе°‘еҗ«жңүдёҖз§Қ CпјҺжҳҜеҗҰеӯҳеңЁNa+йңҖиҰҒйҖҡиҝҮз„°иүІеҸҚеә”жқҘзЎ®е®ҡ DпјҺиӮҜе®ҡдёҚеӯҳеңЁBa2+гҖҒCu2+гҖҒSO32п№ЈгҖҒCO32п№Ј
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дёҚиғҪдҪҝе“Ғзәўжә¶ж¶ІиӨӘиүІзҡ„жҳҜ AпјҺSO2В В В В В В В В В В BпјҺSO3В В В В В В В В В В В В В В В В В В CпјҺHClOВ В В В В В В В DпјҺH2O2
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||
|
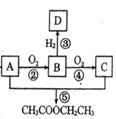
е·ҘдёҡдёҠз”Ёжңүжңәзү©C3H8дёәеҺҹж–ҷеҲ¶еҸ–д№ҷй…ёд№ҷй…ҜгҖӮе®ғ们д№Ӣй—ҙзҡ„иҪ¬еҢ–е…ізі»еҰӮеӣҫпјҡ
В В В В В В В В В В В В В В В В В В В иҜ·еӣһзӯ”пјҡ (1)жңүжңәзү©Bдёӯеҗ«жңүзҡ„е®ҳиғҪеӣўеҗҚз§°жҳҜ________гҖӮ (2)第в‘ӨжӯҘеҸ‘з”ҹеҠ жҲҗеҸҚеә”пјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ____________В В В В В В В В В В В В В В В В В В В гҖӮ (3)дёҖж №ејҜжҲҗиһәж—ӢзҠ¶зҡ„й“ңдёқеңЁз©әж°”дёӯзҒјзғ§еҸҳй»‘еҗҺпјҢиҝ…йҖҹжҸ’е…Ҙзү©иҙЁDдёӯпјҢй“ңдёқеҸҳдёәе…үдә®зәўиүІгҖӮз”ЁеҢ–еӯҰж–№зЁӢејҸи§ЈйҮҠй“ңдёқеҸҳзәўиүІзҡ„еҺҹеӣ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (4)дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AпјҺжңүжңәзү©AдёҺDеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜеҸҚеә”з”ҹжҲҗд№ҷйҶҡ[(CH3CH2)2O] BпјҺз”Ёж–°еҲ¶зўұжҖ§ж°ўж°§еҢ–й“ңжӮ¬жөҠж¶ІеҸҜеҢәеҲҶжңүжңәзү©BгҖҒCе’ҢD CпјҺйҖҡиҝҮзӣҙжҺҘи’ёйҰҸд№ҷй…ёд№ҷй…Ҝе’Ңжңүжңәзү©Cзҡ„ж··еҗҲзү©пјҢеҸҜеҲҶзҰ»еҫ—еҲ°зәҜзҡ„д№ҷй…ёд№ҷй…Ҝ DпјҺзӣёеҗҢжқЎд»¶дёӢд№ҷй…ёд№ҷй…ҜеңЁж°ўж°§еҢ–й’ жә¶ж¶Ідёӯж°ҙи§ЈиҫғеңЁзЁҖзЎ«й…ёдёӯжӣҙе®Ңе…Ё В В В В В В E.В еҸҚеә”иҝҮзЁӢв‘ еңЁзҹіжІ№е·ҘдёҡдёҠз§°дҪңеҲҶйҰҸпјҢеұһдәҺеҢ–еӯҰеҸҳеҢ–гҖӮ
|
||||||||||||
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
е–№зЎ«е№іжҳҜдёҖз§Қйқһз»Ҹе…ёжҠ—зІҫзҘһз–ҫз—…зҡ„иҚҜзү©пјҢеҜ№еӨҡз§ҚзҘһз»ҸйҖ’иҙЁеҸ—дҪ“жңүзӣёдә’дҪңз”ЁпјҢе…¶з»“жһ„дёә
е·ІзҹҘпјҡпјҲв… пјүеҸҚеә”в‘ дёәеҸ–д»ЈеҸҚеә”пјӣпјҲв…Ўпјү иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүВ В В В В В дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В AгҖҒВ зү©иҙЁ BгҖҒВ еҸҚеә”в‘Өзҡ„зӣ®зҡ„жҳҜдҝқжҠӨзўізўіеҸҢй”®пјҢйҳІжӯўиў«ж°§еҢ– CгҖҒВ е–№зЎ«е№ізҡ„еҲҶеӯҗејҸдёәC46H52S2N6O8 DгҖҒВ 1molзү©иҙЁDжңҖеӨҡиғҪдёҺ3molNaOHеҸҚеә” пјҲ2пјүеҲҶеӯҗејҸдёәC13H9NO4Sзҡ„зү©иҙЁзҡ„з»“жһ„з®ҖејҸжҳҜ___________________гҖӮ пјҲ3пјүзү©иҙЁOHCCH=CHCH=CH(CH2)4CHOзҡ„еҗҢеҲҶејӮжһ„дҪ“жңүеӨҡз§ҚпјҢеҶҷеҮәз¬ҰеҗҲдёӢеҲ—жқЎд»¶зҡ„жүҖжңүеҗҢеҲҶејӮжһ„дҪ“зҡ„з»“жһ„з®ҖејҸ___________гҖӮ В В в‘ дёҺ FeCl3жә¶ж¶ІеҸҚеә”жҳҫзҙ«иүІпјӣв‘ЎеҲҶеӯҗдёӯеҗ«дёүдёӘз”Іеҹәпјӣв‘ўж ёзЈҒе…ұжҢҜж°ўи°ұеҸӘжңүеӣӣдёӘеі°. пјҲ4пјүе·ІзҹҘпјҡпјҚSHпјҲе·Ҝеҹәпјүзҡ„жҖ§иҙЁдёҺпјҚOHзӣёдјјпјҢеҲҷ еҢ–еӯҰж–№зЁӢејҸдёә___________________________________________гҖӮ пјҲ5пјү
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
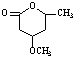
дёәжҺўз©¶еҢ–еҗҲзү©A(д»…еҗ«дёүз§Қе…ғзҙ пјҢж‘©е°”иҙЁйҮҸ198g/mol)зҡ„з»„жҲҗдёҺжҖ§иҙЁпјҢи®ҫ计并е®ҢжҲҗд»ҘдёӢе®һйӘҢпјҡеҸ–3.96gеҢ–еҗҲзү©Aжә¶дәҺж°ҙдёӯпјҢдёҖж®өж—¶й—ҙеҗҺе…ЁйғЁиҪ¬еҢ–дёәBпјҲзәўиӨҗиүІжІүж·ҖпјүгҖҒCпјҲдёҖз§Қзўұпјүе’Ңж°”дҪ“еҚ•иҙЁD(еҸҜдҪҝеёҰзҒ«жҳҹзҡ„жңЁжқЎеӨҚзҮғ),еҗ‘жә¶ж¶ІдёӯеҠ е…Ҙ100mL0.6mol/LзЁҖзЎ«й…ёпјҢеҶҚеҠ е…Ҙеҗ«жңү0.08mol KOHзҡ„жә¶ж¶ІпјҢжҒ°еҘҪе®Ңе…ЁеҸҚеә”гҖӮиҝҮж»ӨпјҢе°Ҷжҙ—ж¶ӨеҗҺзҡ„жІүж·Җе……еҲҶзҒјзғ§пјҢеҫ—еҲ°зәўжЈ•иүІеӣәдҪ“зІүжң«1.60gпјӣе°ҶжүҖеҫ—ж»Өж¶ІеңЁдёҖе®ҡжқЎд»¶дёӢи’ёеҸ‘еҸҜеҫ—еҲ°дёҖз§ҚзәҜеҮҖзҡ„дёҚеҗ«з»“жҷ¶ж°ҙзҡ„зӣҗ10.44gгҖӮ пјҲ1пјүеҢ–еҗҲзү©Aзҡ„еҢ–еӯҰејҸдёәВ В В В В В В В пјӣеҢ–еҗҲзү©AдёҺH2OеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В гҖӮ пјҲ2пјүеҢ–еҗҲзү©AеҸҜз”ұFeCl3е’ҢKClOеңЁејәзўұжҖ§жқЎд»¶дёӢеҸҚеә”еҲ¶еҫ—пјҢе…¶еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В гҖӮ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
жұҪиҪҰе°ҫж°”зҡ„дё»иҰҒжҲҗеҲҶжңүCOгҖҒSO2гҖҒж°®ж°§еҢ–зү©зӯүпјҢз§‘з ”е·ҘдҪңиҖ…зӣ®еүҚжӯЈеңЁе°қиҜ•д»ҘдәҢж°§еҢ–й’ӣ(TiO2)еӮ¬еҢ–еҲҶи§ЈжұҪиҪҰе°ҫж°”зҡ„з ”з©¶гҖӮ пјҲ1пјүе·ІзҹҘпјҡ2NO(g)+O2(g)=2NO2(g)В В В В В О”H1=-113.0KJ/mol В В В В В В В В В В 2SO2(g)+O2(g)=2SO3(1)В В В В В О”H2=-288.4KJ/mol В В В В В В В В В В N2(g) + O2(g) = 2NO(g)В В В В В в–і H3пјқпјӢ180.5 kJВ·molпјҚ1 иҜ·еҲӨж–ӯеҸҚеә”NO2(g)+SO2(g)=NO(g)+SO3(1) О”H4,еңЁдҪҺжё©дёӢиғҪеҗҰиҮӘеҸ‘иҝӣиЎҢпјҢ并иҜҙжҳҺзҗҶз”ұВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүе·ІзҹҘTiO2еӮ¬еҢ–е°ҫж°”йҷҚи§ЈеҺҹзҗҶдёәпјҡ 2CO(g)+O2(g) в… .еңЁO2жө“еәҰеҮ д№ҺдёҚеҸҳзҡ„жқЎд»¶дёӢпјҢжЁЎжӢҹCOгҖҒNOзҡ„йҷҚи§ЈпјҢеҫ—еҲ°йҷҚи§ЈзҺҮйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫ1жүҖзӨәпјҲ в…Ў.еӣҫ2дёәеңЁдёҚеҗҢйў—зІ’й—ҙйҡҷзҡ„жІҘйқ’ж··еҮқеңҹпјҲОұгҖҒОІеһӢпјүе’ҢдёҚеҗҢжё©еәҰдёӢпјҢе®һйӘҢиҝӣиЎҢзӣёеҗҢдёҖж®өж—¶й—ҙпјҲtз§’пјүеҗҺжөӢеҫ—зҡ„COйҷҚи§ЈзҺҮеҸҳеҢ–пјҢеӣһзӯ”и°ўеҲ—й—®йўҳпјҡ
в‘ е·ІзҹҘ50в„ғгҖҒtз§’ж—¶е®№еҷЁдёӯO2жө“еәҰдёә0.01mol/LпјҢжұӮжӯӨжё©еәҰдёӢCOйҷҚи§ЈеҸҚеә”зҡ„е№іиЎЎеёёж•°В В В В В В гҖӮ в‘ЎдёӢеҲ—е…ідәҺеӣҫ2зҡ„еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В A.ж №жҚ®йҷҚи§ЈзҺҮз”ұbзӮ№еҲ°cзӮ№йҡҸжё©еәҰзҡ„еҚҮй«ҳиҖҢеўһеӨ§пјҢеҸҜзҹҘCOйҷҚи§ЈеҸҚеә”зҡ„е№іиЎЎеёёж•°Kb<Kc B.зӣёеҗҢжё©еәҰдёӢОІеһӢжІҘйқ’ж··еҮқеңҹдёӯCOйҷҚи§ЈйҖҹзҺҮжҜ”ОұеһӢиҰҒеӨ§ C.aзӮ№зҡ„ж•°жҚ®еҸҚжҳ еҮәCOдёҺO2д№Ӣй—ҙжүҖеҸ‘з”ҹзҡ„жңүж•Ҳзў°ж’һйў‘зҺҮжҳҜж•ҙдёӘе®һйӘҢиҝҮзЁӢдёӯжңҖй«ҳзҡ„ D.dзӮ№йҷҚи§ЈзҺҮеҮәзҺ°зӘҒеҸҳзҡ„еҺҹеӣ еҸҜиғҪжҳҜжё©еәҰеҚҮй«ҳеҗҺеӮ¬еҢ–еүӮеӨұж•Ҳ в‘ўз§‘з ”еӣўйҳҹд»ҘОІеһӢжІҘйқ’ж··еҮқеңҹйў—зІ’дёәиҪҪдҪ“пјҢе°ҶTiO2ж”№дёәеӮ¬еҢ–ж•ҲжһңжӣҙеҘҪзҡ„TiO2зәізұіз®ЎпјҢеңЁ10-60в„ғиҢғеӣҙеҶ…иҝӣиЎҢе®һйӘҢпјҢиҜ·еңЁеӣҫ2дёӯз”Ёзәҝж®өдёҺйҳҙеҪұд»ҝз…§вҖңзӨәдҫӢвҖқжҸҸз»ҳеҮәCOйҷҚи§ЈзҺҮйҡҸжё©еәҰеҸҳеҢ–зҡ„жӣІзәҝеҸҜиғҪеҮәзҺ°зҡ„жңҖеӨ§еҢәеҹҹиҢғеӣҙпјҲзӨәдҫӢпјҡ пјҲ3пјүTiO2зәізұіз®Ўзҡ„еҲ¶еӨҮжҳҜеңЁејұй…ёжҖ§ж°ҙжә¶ж¶Ідёӯд»ҘйҮ‘еұһй’ӣдёәйҳіжһҒиҝӣиЎҢз”өи§ЈпјҢеҶҷеҮәйҳіжһҒзҡ„з”өжһҒеҸҚеә”ејҸВ В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
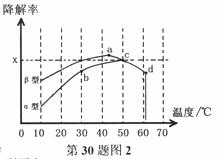
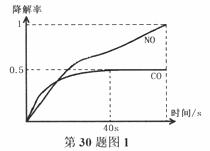
е·ІзҹҘиҝҳеҺҹжҖ§Iп№ЈпјһFe2+пјһI2пјҢеңЁж°ҙжә¶ж¶ІдёӯI2еҸҜиў«Cl2ж°§еҢ–дёәIO3п№ЈпјҢеҗ‘еҗ«жә¶иҙЁamolзҡ„FeI2жә¶ж¶ІдёӯйҖҡе…Ҙbmol Cl2пјҢе……еҲҶеҸҚеә”пјҲдёҚиҖғиҷ‘еҚ•иҙЁдёҺж°ҙзҡ„еҸҚеә”пјүпјҺ пјҲ1пјүеҪ“a=2bж—¶пјҢеҸҚеә”еҗҺзҡ„зІ’еӯҗжө“еәҰд№ӢжҜ”пјҡc(Fe2+)пјҡc(Iп№Ј)пјҡc(Clп№Ј)=________гҖӮ пјҲ2пјүиӢҘеҸҚеә”еҗҺжә¶ж¶ІдёӯI2дёҺIO3п№Јзҡ„зү©иҙЁзҡ„йҮҸдёә1пјҡ1пјҢеҲҷеҸҚеә”дёӯиҪ¬з§»зҡ„з”өеӯҗ_______molпјҲз”Ёеҗ«aзҡ„д»Јж•°ејҸиЎЁзӨәпјүгҖӮ
|
|
| 31. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||||||||||||
|
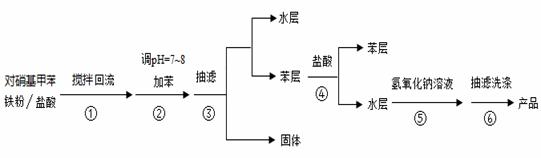
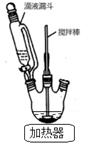
еҜ№з”ІеҹәиӢҜиғәеҸҜз”ЁеҜ№зЎқеҹәз”ІиӢҜеңЁй…ёжҖ§жқЎд»¶дёӢз”Ёй“ҒзІүиҝҳеҺҹеҲ¶еҫ—пјҡ
дё»иҰҒеҸҚеә”зү©е’Ңдә§зү©зҡ„зү©зҗҶжҖ§иҙЁи§ҒдёӢиЎЁпјҡ е®һйӘҢжөҒзЁӢеҰӮдёӢпјҡ иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҸҚеә”иЈ…зҪ®еҰӮеҸіеӣҫпјҢaеӨ„зјәе°‘дёҖиЈ…зҪ®_____________(еЎ«д»ӘеҷЁеҗҚз§°)
пјҲ3пјүжӯҘйӘӨв‘ўеҫ—еҲ°зҡ„еӣәдҪ“зү©иҙЁдёә_________ пјҲ4пјүжӯҘйӘӨв‘ЈдёӯеҠ е…Ҙзӣҗй…ёзҡ„дҪңз”ЁжҳҜ_____________ пјҲ5пјүжӯҘйӘӨв‘ӨдёӯйҖҡиҝҮеҠ е…Ҙж°ўж°§еҢ–й’ жә¶ж¶ІдҪҝеҜ№з”ІеҹәиӢҜиғәз»“жҷ¶жһҗеҮәзҡ„ еҺҹзҗҶдёә_____________ еҸҚеә”иЈ…зҪ® A. и’ёйҰҸж°ҙВ В В BпјҺд№ҷйҶҮВ В В CпјҺNaOHжә¶ж¶ІВ В В DпјҺHClжә¶ж¶І
|
||||||||||||||||||||||||||||||||||||
- зәўжІіеҺҝ第дёҖдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- 2019-2020е№ҙй«ҳдёҖеҗҺеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеұұдёңзңҒж–°жі°еёӮ第дёҖдёӯеӯҰпјү
- йҰҷжІіеҺҝ第дёүдёӯеӯҰ2018е№ҙй«ҳдәҢдёҠеҚҠе№ҙеҢ–еӯҰжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- 2019-2020е№ҙй«ҳдёҖдёӢеҚҠе№ҙйӘҢ收иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲеҗүжһ—зңҒ延иҫ№еёӮй•ҝзҷҪеұұ第дёҖй«ҳзә§дёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдәҢдёҠжңҹжңҹжң«ж•ҷеӯҰиҙЁйҮҸжЈҖжөӢзҗҶ科综еҗҲеҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲе№ҝдёңзңҒжҪ®е·һеёӮпјү
- жұҹйҳҙеӣӣж Ўй«ҳдәҢеҢ–еӯҰжңҹдёӯиҖғиҜ•пјҲ2018е№ҙдёҠеҚҠе№ҙпјүеңЁзәҝе…Қиҙ№иҖғиҜ•
- ж–°д№ЎеёӮ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҚҠжңҹй«ҳиҖғжЁЎжӢҹеёҰеҸӮиҖғзӯ”жЎҲдёҺи§Јжһҗ
- й»‘йҫҷжұҹзңҒеӨ§еәҶй“ҒдәәдёӯеӯҰ2020-2021е№ҙй«ҳдәҢеүҚеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ