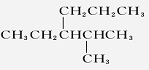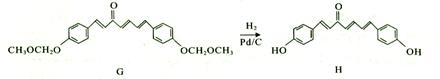2018甘肃高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
下列关于化学与生产、生活的说法不正确的是 A“火树银花”焰火的实质是金属元素的焰色反应 B酸雨是碳、氮、硫的氧化物大量排放引起的 C侯氏制碱法中使用氨水是利用了其溶于水溶液呈碱性 D工业上由石油获取乙烯的过程中既有物理变化又有化学变化
|
|
| 2. | 详细信息 |
|
2017年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是 A.夏天设定空调温度尽可能的低 B.推广使用一次性塑料袋和纸巾 C.少开私家车多乘公共交通工具 D.对商品进行豪华包装促进销售
|
|
| 3. | 详细信息 |
|
化学与生活密切相关,下列有关说法错误的是( ) A.用灼烧的方法可以区分蚕丝和人造纤维 B.食用油反复加热会产生稠环芳烃等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.医用消毒酒精中乙醇的浓度为95%
|
|
| 4. | 详细信息 |
|
下列化学用语使用科学规范的是
B. 作为相对原子质量标准的原子146C. C. CaCl2的电子式:
|
|
| 5. | 详细信息 | |||||||||||||||
|
根据下列实验操作和现象所得到的结论正确的是
|
||||||||||||||||
| 6. | 详细信息 |
|
下列推断正确的是 A. NO和N02的密度都比空气大,都可以用向上排空气法收集 B. Na20和Na202组成元素相同,与C02反应产物也完全相同 C. S02和C02都是酸性氧化物,都能与NaOH溶液反应 D. C3H8和CH3CH20H相对分子质量相近,二者沸点也相近
|
|
| 7. | 详细信息 |
|
烷烃 A.4-甲基-3-丙基戊烷 B.3-异丙基己烷 C.2-甲基-3-丙基戊烷 D.2-甲基-3-乙基己烷
|
|
| 8. | 详细信息 |
|
下列关于有机化合物的说法正确的是( ) A.2-甲基丁烷也称异丁烷 B.由乙烯生成乙醇属于加成反应 C.C4H9Cl有3种同分异构体 D.油脂和蛋白质都属于高分子化合物
|
|
| 9. | 详细信息 |
|
两个氯原子处于相邻碳原子上的分子式为C5H10Cl2的同分异构体共有(不考虑立体异构) A.3种 B.4种 C.5种 D.6种
|
|
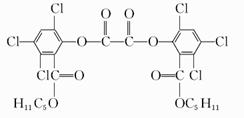
| 10. | 详细信息 |
|
夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图:
A.草酸二酯的分子式为C26H22O8Cl6 B.1 mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗6 mol NaOH C.草酸二酯水解可以得到两种有机物 D.1 mol草酸二酯与氢气完全反应,需要氢气10 mol
|
|
| 11. | 详细信息 |
|
下列说法不正确的是(NA表示阿佛加德罗常数) A.含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA B.4.6 g Na与足量的稀盐酸反应,转移电子数一定为0.2NA C.1L 0.1mol·L-1的Na2CO3中CO32-数目小于0.1 NA D.常温下,22g CO2含碳氧双键数目为NA
|
|
| 12. | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是 A.Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂 B.ClO2具有还原性,可用于自来水的杀菌消毒 C.SiO2硬度大,可用于制造光导纤维 D.NH3易溶于水,可用作制冷剂
|
|
| 13. | 详细信息 |
|
设NA代表阿伏加德罗常数,下列叙述正确的是 A.0.012Kg14C所含的碳原子数为 NA B.将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA C.常温常压下16 g O2和O3混合气体中,氧原子数为NA D.7.8 g Na2O2与足量水反应,转移电子数为0.2NA
|
|
| 14. | 详细信息 |
|
下列物质间能按照下面流程直接转化的元素是
A.氯 B.硫 C.铝 D.铁
|
|
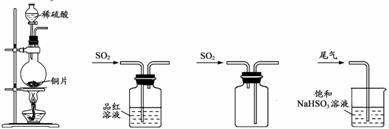
| 15. | 详细信息 |
|
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
|
|
| 16. | 详细信息 |
|
下列四种有色溶液与SO2气体作用均能褪色,其实质相同的是 ①酸性高锰酸钾溶液 ②品红溶液 ③溴水 ④滴有酚酞的氢氧化钠溶液 A.①③ B.②③ C.①④ D.②④
|
|
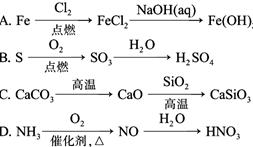
| 17. | 详细信息 | |||||||||||||||
|
下列实验操作能达到实验目的的是
|
||||||||||||||||
| 18. | 详细信息 |
|
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是 A.原子半径: r(X) < r(Y) < r(Z) < r(W) B.W的最高价氧化物的水化物是一种弱碱 C.Y的单质的氧化性比Z的强 D.X、Y、Z 三种元素可以组成共价化合物和离子化合物
|
|
| 19. | 详细信息 |
|
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaC1O、NaClO3的混合溶液,经测定,ClO-与ClO3-的物质的量浓度之比为1:3,则此反应中被还原的氯元素与被氧化的氯元素原子的物质的量之比是 A. 1: 4 B. 11:3 C. 4:1 D. 3:1
|
|
| 20. | 详细信息 |
|
下列指定反应的离子方程式正确的是 A.钠与水反应: Na +2H2O B.电解饱和食盐水获取烧碱和氯气: 2Cl–+2H2O C.向氢氧化钡溶液中加入稀硫酸: Ba2++OH– + H+ + D.向碳酸氢铵溶液中加入足量石灰水: Ca2++
|
|
| 21. | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能实现的是
|
|
| 22. | 详细信息 | ||||||||||||||||||||
|
下表中各组物质不能实现如图转化的是
|
|||||||||||||||||||||
| 23. | 详细信息 |
|
Ag2Se单晶呈六角微型管状,有望开发为新型材料,其制取原理为4AgCl+ 3Se+ 6NaOH=2Ag2Se +Na2Se03+4NaCl+ 3H20。关于该反应的下列叙述正确的是 A. AgCl作氧化剂 B.6 molNaOH参加反应转移6 mol e- C.被还原硒与被氧化硒的质量之比为1:2 D.被还原硒与被氧化硒的物质的量之比为2:1
|
|
| 24. | 详细信息 |
|
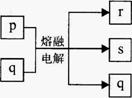
短周期元素X、Y、Z、W的原子序数依次增大,其中Z与W为金属元素,四种元素的简单离子的电子层结构均相同。p、q是它们中的部分元素组成的化合物,r是X的单质, s是W的单质。这些物质间的转化关系如图所示。下列说法正确的是 A.原子半径:W>Z>Y>X B.r在电解池的阳极产生 C.p能与盐酸反应,但不能与氢氧化钠溶液反应 D.q在图示转化过程中起到了催化剂的作用
|
|
| 25. | 详细信息 |
|
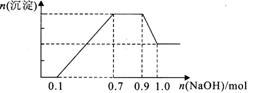
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、C032-、S042-、N03-中的几种。①若加入锌粒,能产生无色无味无毒的气体;②若加入NaOH溶液,产生沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是 A.溶液中的阳离子只有H+、Mg2+、Al3+、NH4+ B.溶液中n(NH4+)=0.2mol C.溶液中一定不含C032-,可能含有S042-和N03- D.物质的量之比n(H+):n(Al3+): n(Mg2+)=1:1:1
|
|
| 26. | 详细信息 | ||||
|
有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阴离子,且互不重复)。
已知:①A、C溶液的pH均大于7,B溶液的pH小于7;D溶液焰色反应显黄色。 ②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后加热生成有刺激性气味的气体。 (1)写出D的化学式:___ _; (2)写出C溶液与D溶液反应的离子方程式: 。 (3) 25℃时,pH=9的A溶液和pH=9的C溶液中由水电离产生的OH-的物质的量浓度之比为____ 。 (4) 25℃时,用惰性电极电解D的水溶液,一段时间后溶液的pH_ 7(填“>”“<”或“=”) (5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为____
|
|||||
| 27. | 详细信息 |
|
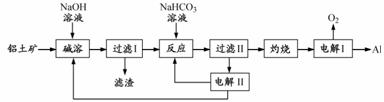
铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
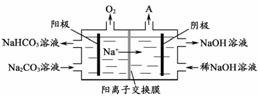
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。 (1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。 (2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。并结合题中信息写出该反应的离子方程式___________。 (3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。 (4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阳极的电极反应式为_________________,阴极产生的物质A的化学式为____________。 (5)电解产生的Al常用于大量生产各种铝合金,为测定某种铝硅合金的组成,将相同质量的合金分别与足量的盐酸和NaOH溶液充分反应生成H2在相同条件下的体积比为3:5,则Al和Si的物质的量比为 。
|
|
| 28. | 详细信息 |
|
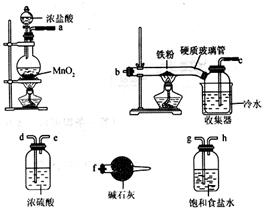
已知三氯化铁的熔点为306 ℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
(1) 装置的连接顺序为_________。 (2) 饱和食盐水的作用是_________。 (3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为_______。 ②淡红色溶液中加入过量H2O2后溶液红色加深的原因是_________。 (4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行如下探究。 ①取褪色后溶液三份,第一份滴加FeCl2溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。 ②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2无明显变化。 实验①说明____________;由实验②得出的结论是________;
|
|
| 29. | 详细信息 |
|
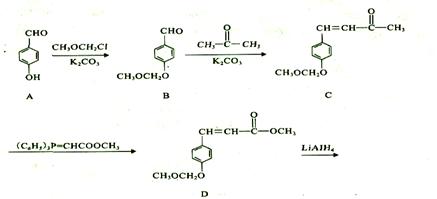
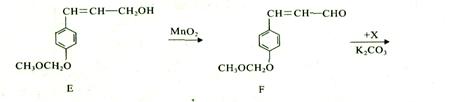
我国科研人员从天然姜属植物分离出一种具有显著杀菌、消炎、解毒作用的化合物H。 H的合成路线如下:
(1) A-;B的反应类型是______,H的摩尔质量为 _g/mol。 (2)化合物B中的含氧官能团为____和____(填官能团名称)。 (3)写出同时满足下列条件的B的_种同分异构体的结构简式: 。 I.苯环上有两个取代基; II.分子中有6中不同化学环境的氢; III.既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应。 (4)实现F—G的转化中,加入的化合物X(C12H1403)的结构简式为____。
|
|