2019吉林高一下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
决定化学反应速率的根本因素是 ( ) A.温度和压强 B.反应物的浓度 C.参加反应的各物质的性质 D.催化剂的加入
|
|
| 2. | 详细信息 |
|
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( ) A. 蚕丝的主要成分是蛋白质 B. 蚕丝属于天然高分子材料 C.“蜡炬成灰”过程中发生了氧化反应 D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
|
|
| 3. | 详细信息 |
|
下列物质属于离子化合物且含有共价键的是 ( ) A. N2 B. MgCl2 C. HCl D. KOH
|
|
| 4. | 详细信息 |
|
NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的 ( ) A.使用催化剂并不能改变反应速率 B.使用催化剂可以加快反应速率 C.降低压强能加快反应速率 D.降温可以加快反应速率
|
|
| 5. | 详细信息 |
|
下列与化学反应能量变化相关的说法不正确的是( )
|
|
| 6. | 详细信息 |
|
下列元素的性质比较正确的是 A.原子半径:O>S B.非金属性:C>N C.金属性:Al>Na D.最高化合价:S>Si
|
|
| 7. | 详细信息 |
|
下列元素中,原子半径最大的是
|
|
| 8. | 详细信息 |
|
下列表达方式错误的是 ( ) A.碱性NaOH>Mg(OH)2>Al(OH)3 B.氟化钠的电子式 C.酸性 HClO > H2SO4 D.碳-12原子126C
|
|
| 9. | 详细信息 |
|
下列说法中正确的是( ) A.植物油氢化过程中发生了加成反应 B.纤维素和淀粉互为同分异构体 C.环己烷与苯可用高锰酸钾溶液鉴别 D.水可以用来分离四氯化碳和苯的混合物
|
|
| 10. | 详细信息 | |||||||||||||||
|
下列由实验得出的结论正确的是( )
|
||||||||||||||||
| 11. | 详细信息 | |||
|
把0.6molX气体和0.2molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/ (L· min),则n的值为 A.4 B.3 C.2 D.1
|
||||
| 12. | 详细信息 |
|
在2A + B A.v(A)=0.3mol/L· s B.v(B)=0.3mol/L· s C.v(C)=0.3mol/L· s D.v(D)=1mol/L· s
|
|
| 13. | 详细信息 |
|
.(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。 已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol, N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ/mol,
|
|
| 14. | 详细信息 |
|
可以充分说明反应P(g)+Q(g) ⇌ R(g)+S(g)在恒温下已达到平衡的是 ( ) A.反应容器内的压强不随时间改变 B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1 C.P的生成速率和S的生成速率相等 D.反应容器内的气体总物质的量不随时间变化
|
|
| 15. | 详细信息 |
|
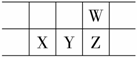
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:W < X B.常温常压下,Y单质为固态 C.气态氢化物热稳定性:Z < W D.X的最高价氧化物的水化物是强碱
|
|
| 16. | 详细信息 |
|
高温下,某反应达平衡,平衡常数K= A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小 C.升高温度,逆反应速率增大,正反应速率减小 D.该反应的化学方程式为CO+H2O ⇌CO2+H2
|
|
| 17. | 详细信息 |
|
在密闭容器中发生反应aA(g) ⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( ) A.A的转化率增大 B.平衡向正反应方向移动 C.D的体积分数变大 D.a<c+d
|
|
| 18. | 详细信息 |
|
H2O2俗称双氧水,医疗上常用3%的双氧水进行伤口或耳炎消毒。下列关于H2O2的说法正确的是( ) A. H2O2分子中含有氢离子 B. H2O2分子中既有离子键,又有共价键 C. H2O2属于共价化合物 D. H2O2属于H2和O2组成的混合
|
|
| 19. | 详细信息 |
|
下列元素中最高正化合价为+7价的是 ( ) A. Cl B. H C. N D. He
|
|
| 20. | 详细信息 |
|
下列物质含有离子键的是 ( ) A. Br2 B. CO2 C. H2O D. KOH
|
|
| 21. | 详细信息 |
|
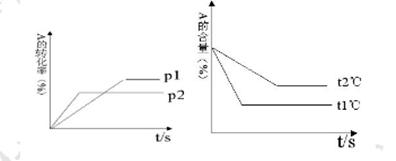
可逆反应:aA(g)+ bB(g)⇌cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2 (填大或小); (2)(2)(a +b)比(c +d) (填大或小); (3)温度t1℃比t2℃ (填高或低); (4)(4)正反应为 反应。
|
|
| 22. | 详细信息 |
|
Ⅰ.有下列各组物质; A、O2和O3(臭氧) B、12C和13C C、CH3CH2CH2CH3和CH3CH(CH3)2 D、 E、葡萄糖和果糖 F、淀粉和纤维素 G、液氯和氯气 (1)______组两物质互为同位素 (2)______组两物质互为同素异形体 (3)______组两组物质互为同分异构体 (4)______组中的物质是同一物质 II、现有下列5种有机物A.苯 B.乙烯 C.乙烷 D.乙醇 E.乙酸。(填代号) (1)能与H2发生加成反应的有______________。 (2)能与Na反应的有______________________。 (3)能与NaOH溶液反应的有________________。 (4)常温下能与溴水发生化学反应的有________________。
|
|
| 23. | 详细信息 |
|
T ℃时,将3 mol A气体和2 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g) ⇌xC(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol/L。 请填写下列空白: (1)x=________。 (2)用B表示该反应的速率为________mol/(L·min),A的转化率为________。 (3)该温度下平衡常数表达式为: 。
|
|
| 24. | 详细信息 |
|
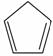
节选2019高考(4分) 环戊二烯( (1)已知: H2(g)+ I2(g) 对于反应:
|
|
| 25. | 详细信息 |
|
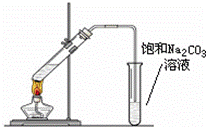
实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是: ; (2)乙酸乙酯在饱和碳酸钠溶液的_______层;(填“上”或“下”) (3)浓硫酸的作用是______________; (4)制取乙酸乙酯的化学方程式是 ,该反应属于 (填反应类型)反应; (5)饱和碳酸钠的作用是: ; (6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。 ①混合物中各物质的浓度不再变化; ②单位时间里,生成1mol乙醇,同时生成1mol乙酸; ③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。 |
|
| 26. | 详细信息 |
|
A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
(1)A的结构式为___________。 (2)B分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。 (3)写出下列反应的化学方程式并指出反应类型: ①____________________________:反应类型是______________; ②____________________________;反应类型是______________;
|
|