2018山西高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
中国古代科学著作《天工开物》中有言:“世间丝、麻、裘、褐皆具素质”,那么“裘”的主要成分是 A.油脂 B.维生素 C.纤维系 D.蛋白质
|
|
| 2. | 详细信息 |
|
《本草纲目》中对白矾之用有如下叙述:“吐利风热之痰涎,取其酸苦涌泄也;治诸血痛,脱肛……取其酸涩而收也………下列说法错误的是 A.治血痛的原因是利用了胶体的聚沉 B.白矾溶于水后微粒浓度排序: c (H2O)>c (SO42-) >c (Al3+) >c (K+) >c(OH-)>c(H+) C.检测“无矾油条”是否含“矾”的方法是: 将油条加热碳化→加水溶解→过滤→滤液中逐滴加入NaOH 溶液 D.白矾在油条中做膨化剂的原理是: A13++ 3HCO3-= Al(OH)3↓+3CO2↑
|
|
| 3. | 详细信息 |
|
曾因可能致癌而陷舆论风波的除草剂一一草甘膦已于2017 年11月被相关部门正式批准可维续使用,其结构如图所示,下列说法不正确的是
A.1mol 的草甘膦可以与3mol 的NaOH中和 B.分子式为C3H8NO5P C.可以溶于水 D.属于酯类的同分异构体只有两种
|
|
| 4. | 详细信息 |
|
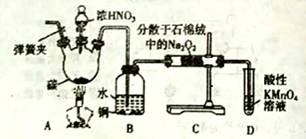
亚硝酸钠(NaNO3)是工业盐的主要成分,在漂白、电镀等方面应用广泛。己知: 室温下,2NO+Na2O2= =2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(部分夹持装置已略去)下列说法正确的是
A.实验开始前先向装置中通入N2,实验结束时先停止通入N2再熄灭酒精灯 B.可以将B中药品换成NaOH 溶液 C.应在B、C之间加一个盛放碱石灰的干燥管 D.D装置用于尾气处理,标况下,每吸收11.2L的尾气消耗0.2mol 的高锰酸钾
|
|
| 5. | 详细信息 |
|
2005 年,法拉利公司发布的敞篷车(法拉利Superamerica),其玻璃车项采用了先进的电致变色技术,即在原来玻璃材料基础上增加了有电致变色系统组成五层中膜材料(如下图所示)。其工作原理是: 在外接电源(外加电场) 下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节,下列有关说法不正确的是
A.当A接外接电源负极时,电致变色层发生反应为: WO3+Li++e-= LiWO3 B.当A接外接电源正极时,Li+脱离离子存储层 C.该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变 D.当B接外接电源正极时,膜的透射率降低,可以有效阻挡阳光
|
|
| 6. | 详细信息 |
|
短周期主族元素R、X、Y、Z、T 的原子序数依次增大,由这五种元素组成一种复盐(含2 种阳离子和1种阴离子的盐) M。M 中阳离子和阴离子总数相等。取少量M 溶于水,将所得溶液分成两份:一份滴加氯化钡溶液和盐酸,产生白色沉淀;另一份痛加氢氧化钠溶液,先产生白色沉淀,继续滴加则白色沉淀消失,反应过程中产生有刺激性气味的气体。下列说法正确的是 A.R、X 可以形成X2R4,电子式为 B.气态氢化物的稳定性: XH3>H2Y>H2T C.Y 和Z形成的氧化物常作为除去A1Cl3溶液中少量的Fe3+的沉淀剂 D.M 的水溶液中离子浓度大小排序为:c(SO42-) >c(Al3+) > c(NH4+) > c(H+) > c(OH-)
|
|
| 7. | 详细信息 |
|
常温下将NaOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
A.Ka2(H2X)的数量级为10–4 B. NaHX溶液中c(H+)>c(OH-) C.曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系 D.当混合溶液呈中性时,c(Na+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
|
|
| 8. | 详细信息 |
|
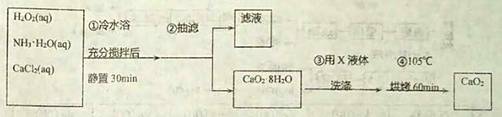
过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在破性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一) 如下:
请回答下列问题: (1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________; (2)支管B 的作用是___________________________________; (3)步骤3中洗涤CaO2·8H2O的液体X 的最佳选择是______; A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液 (4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质; A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌 (5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体) ①检查该装置气密性的方法________________________;②使用______(填仪器名称)准确称取0.5000g 样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况) 气体,则产品中过氧化钙的质量分数为__________________(保留4 位有效数字)
|
|
| 9. | 详细信息 | ||||||||||||
|
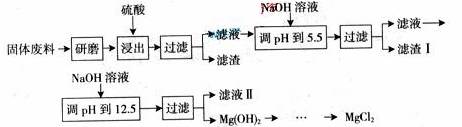
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、A12O3和Fe2O3等,回收其中镁的工艺流程如下:
部分阳离子以氢氧化物形式完全深沉时溶液的pH 由见上表 (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_____________________(要求写出两条) (2)滤渣I的主要成分有_________________________。 (3)从滤液II中可回收利用的主要物质有________________________。 (4)若最终得到的氯化镁溶液中,c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1 ,此时是否有Mg3(PO4)2沉淀生成?_______(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。 (5) Mg (C1O3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl已知四种化合物的溶解度(S) 随温度(T) 变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg (ClO3)2。简述可制备Mg (ClO3)2的原因:_______________________。 ②按①中条件进行制备实验。在冷却降温析出Mg (ClO3)2过程中,常伴有NaCl 析出,原因是:__________。除去产品中该杂质的方法是:___________________________________________。
|
|||||||||||||
| 10. | 详细信息 |
|
最新研究表明,有毒气体H2S具有参与调节神经信号传递、舒张血管减轻高血压的功能。 (i)下列事实中,可以用来比较H2S与H2SO3的酸性强弱的是______(填标号)。 A.H2S 的还原性强于H2SO3 B.0.10 mol·L-1的H2S和H2SO3的pH分别为4.5和2.1 C.H2S 不能与NaHCO3溶液反应,而H2SO3可以 D.等浓度的两种溶液pH 值: NaHS > NaHSO3 (2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知(1)式和(5)式的热化学方程式分别为___________、________________,制得等量H2所需能量系统I是系统II的_______倍。 (3) H2S与CO2在高温下发生反应: H2S(g)+CO2(g) ①H2S的平衡转化率a1=_______%,反应平衡常数K=______________。 ②在不同条件下发生上述反应,COS 的体积分数随时间(t)的变化如图所示,根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是____________(填字母序号)CO2的转化率a2__a1,(填”>”或“<”) A.压强 B.温度 C.催化剂
(4)反应开始,保持T1温度,2L 钢瓶中充入0.08molCO2、0.40mo1H2S、0.02molCOS和0.02molH2O,则此时V正___V逆(填”>”或“<”)判断依据是___________________________。
|
|
| 11. | 详细信息 |
|
已知X、Y、Z、W是中学常见的四种元素,原子序数依次增大。X的原子最外层电子数是次外层的2倍,Y 的氧化物属于两性氧化物,Y、Z 位于同周期,X、Y、Z的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。 (1) X在元素周期表中的位置是_________________。 (2)下列事实能用元素周期律解释的是_____________________________________(填字母序号)。 A.Y 的最高价氧化物对应水化物的碱性弱于Mg(OH)2 B.Z的气态氢化物的稳定性小HF C.WY3的溶液可用于刻蚀铜制的印刷电路板 (3)Z的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是______________________。 (4)工业上用电解法制各Y单质,化学方程式为___________________________。 (5)家用“管道通”的有效成分是烧碱和Y 的单质,使用时需加入一定量的水,此时发生反应的化学方程式为______________________________。 (6) W的单质可用于处理酸性废水中的NO3-,使其转化成为铵根离子,同时生成磁性的W的氧化物H,再进行后续处理。相应离子方程式为____________。Y 的单质与H在高温下反应的化学方程式为_________。
|
|