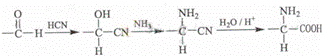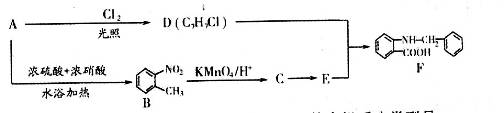2016жІіеҚ—й«ҳдёүдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
В еңЁеҢ–иӮҘе’ҢеҶңиҚҜзҡ„ж–Ҫз”ЁиҝҮзЁӢдёӯпјҢдёӢеҲ—ж“ҚдҪңжӯЈзЎ®зҡ„жҳҜ A. дёәдәҶжҸҗй«ҳеҗ«ж°®йҮҸпјҢеҸҜд»ҘдёҚеҝ…иҖғиҷ‘ж–Ҫз”ЁиҝҮзЁӢдёӯеҢ–иӮҘеҜ№еңҹеЈӨдә§з”ҹзҡ„дёҚиүҜеҪұе“Қ B. зўій“өеҢ–иӮҘеҸҜд»Ҙе’ҢзўұжҖ§иҚүжңЁзҒ°ж··еҗҲдҪҝз”Ё C. дёәеўһејәдҪңзү©зҡ„жҠ—еҜ’гҖҒжҠ—ж—ұиғҪеҠӣпјҢеҸҜд»ҘйҖӮеҪ“ең°ж–Ҫз”ЁдёҖдәӣзЈ·иӮҘ D. дҪҝз”ЁдәҶжҹҗдёҖж•Ҳжһңжҳҫи‘—зҡ„жқҖиҷ«еүӮеҗҺпјҢеҸҜд»ҘдёҚеҝ…жӣҙжҚўе“ҒзүҢй•ҝжңҹдҪҝз”Ё
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұдәҺзўҳжҳҜеҚӨзҙ дёӯеҺҹеӯҗеҚҠеҫ„иҫғеӨ§зҡ„е…ғзҙ пјҢеҸҜиғҪе‘ҲзҺ°йҮ‘еұһжҖ§гҖӮдёӢеҲ—дәӢе®һиғҪеӨҹж”ҜжҢҒиҝҷдёӘз»“и®әзҡ„жҳҜ(гҖҖгҖҖ) A.е·Із»ҸеҲ¶еҫ—дәҶI2O5зӯүзўҳзҡ„ж°§еҢ–зү© B.еңЁIBrгҖҒIClзӯүеҚӨзҙ дә’еҢ–зү©дёӯзўҳе…ғзҙ иЎЁзӨәжӯЈд»· C.е·Із»ҸеҲ¶еҫ—дәҶIпјҲNO3пјү3гҖҒIпјҲClO4пјү3В·2H2OзӯүзҰ»еӯҗеҢ–еҗҲзү© D.зўҳпјҲI2пјүжҳ“жә¶дәҺKIзӯүзўҳеҢ–зү©жә¶ж¶ІпјҢеҪўжҲҗI-3зҰ»еӯҗ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ«жңүзӣёеҗҢе…ғзҙ зҡ„еҢ–еҗҲзү©з»„жҳҜ A.O2В O3В В В В В В В В В В В В В B.COВ CO2В В В В В В В C.KClВ ALCl3В В В В В В В D.NaHCO3гҖҒNaHSO4
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ:з”ІиӢҜзҡ„жҖ§иҙЁдёҺиӢҜзӣёдјј,дёҚеҗҢеңЁдәҺз”ІиӢҜиғҪеӨҹиў«й…ёжҖ§й«ҳй”°й…ёй’ҫжүҖж°§еҢ–гҖӮйүҙеҲ«иӢҜгҖҒз”ІиӢҜгҖҒе·ұзғҜеә”йҖүз”Ёзҡ„дёҖз»„иҜ•еүӮжҳҜ(гҖҖгҖҖ)гҖӮ в‘ жәҙж°ҙгҖҖв‘Ўй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІгҖҖв‘ўзЁҖзЎ«й…ёгҖҖв‘ЈNaOHжә¶ж¶І A.в‘ в‘ЎВ В В В В В B.в‘Ўв‘ў C.в‘ўв‘ЈВ В В В В В D.в‘ в‘ў
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
е®Өжё©дёӢпјҢ0.1molВ·L-1жҹҗдёҖе…ғејұзўұпјҲAOHпјүжә¶ж¶ІдёӯcпјҲOH-пјү/cпјҲH+пјү=1.0Г—108пјҢдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ В В В AпјҺиҜҘдёҖе…ғзўұжә¶ж¶Ізҡ„pH=11 В В В BпјҺиҜҘжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„cпјҲOH-пјү=1.0Г—10-11molВ·L-1 В В В CпјҺиҜҘжә¶ж¶Ідёӯж°ҙзҡ„зҰ»еӯҗз§Ҝеёёж•°KWдёә1.0Г—10-14molВ·L-2 В В В DпјҺз”ЁpH=1зҡ„зӣҗй…ёжә¶ж¶ІV1LдёҺV2L0.1molВ·L-1зҡ„AOHжә¶ж¶Іж··еҗҲпјҢиӢҘж··еҗҲжә¶ж¶ІpH=7пјҢеҲҷV1=V2
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҹҗжё©еәҰдёӢпјҢNaOHзҡ„жә¶и§ЈеәҰдёә20е…ӢпјҢиҜҘжё©еәҰдёӢе°Ҷ40е…ӢNaOHж”ҫе…Ҙ110е…Ӣж°ҙдёӯпјҢе……еҲҶжҗ…жӢҢеҗҺпјҢжөӢзҡ„жә¶ж¶Ізҡ„еҜҶеәҰдёә1.2g/mLпјҢеҲҷжә¶ж¶Ідёӯжә¶иҙЁзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә AпјҺ5.0mol/LВ В В В В BпјҺ0.02mol/LВ В В В В CпјҺ2.0mol/LВ В В В В DпјҺ0.8mol/L
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжә¶ж¶Ідёӯеҗ«жңүеӨ§йҮҸзҡ„дёӢеҲ—зҰ»еӯҗпјҡFe3пјӢгҖҒSO42пјҚгҖҒAl3пјӢе’ҢMзҰ»еӯҗпјҢдё”иҝҷеӣӣз§ҚзҰ»еӯҗFe3пјӢгҖҒSO42пјҚгҖҒAl3пјӢе’ҢMзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә2пјҡ4пјҡ1пјҡ1пјҢеҲҷMзҰ»еӯҗеҸҜиғҪдёәдёӢеҲ—дёӯзҡ„ AпјҺNa+В В В В В В В В В В В В BпјҺOH-В В В В В В В В В В В В CпјҺS2-В В В В В В В В В DпјҺCl-
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫжҳҜжҹҗжңүжңәзү©еҲҶеӯҗзҡ„жҜ”дҫӢжЁЎеһӢпјҢжңүе…іиҜҘзү©иҙЁзҡ„жҺЁж–ӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ пјү
AпјҺеҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүзҫҹеҹәВ В В В В BпјҺеҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүзҫ§еҹә CпјҺеҲҶеӯҗдёӯеҸҜиғҪеҗ«жңүж°ЁеҹәВ В В В В DпјҺиҜҘзү©иҙЁзҡ„еҲҶеӯҗејҸеҸҜиғҪдёәC3H6O3
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Ідёӯж°ҜзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёҺ50 mL 1 molВ·L-1AlCl3жә¶ж¶Ідёӯж°ҜзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯүзҡ„жҳҜ AпјҺ150 mL 3 molВ·L-1ж°Ҝй…ёй’ жә¶ж¶ІВ В В В В В BпјҺ75 mL 3 molВ·L-1ж°ҜеҢ–й’ҷжә¶ж¶І CпјҺ150 mL 3 molВ·L-1ж°ҜеҢ–й’ҫжә¶ж¶ІВ В В В В В DпјҺ50 mL 3 molВ·L-1ж°ҜеҢ–й•Ғжә¶ж¶І
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ В В В В В В В В В В В В В В В В В В В В В В В В AпјҺеңЁеҜҶй—ӯе®№еҷЁдёӯеҠ е…Ҙ1.5 mol H2е’Ң0.5 mol N2пјҢе……еҲҶеҸҚеә”еҗҺеҸҜеҫ—еҲ°NH3еҲҶеӯҗж•°дёәNA BпјҺдёҖе®ҡжқЎд»¶дёӢпјҢ2.3 gзҡ„Naе®Ңе…ЁдёҺO2еҸҚеә”з”ҹжҲҗ3.6 gдә§зү©ж—¶еҫ—еҲ°зҡ„з”өеӯҗж•°дёә0.1NA CпјҺ1.0 Lзҡ„0.1 molВ·LпјҚ1 Na2Sжә¶ж¶Ідёӯеҗ«жңүзҡ„Na+зҰ»еӯҗж•°дёә0.2NA DпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 Lзҡ„CCl4дёӯеҗ«жңүзҡ„CCl4еҲҶеӯҗж•°дёәNA
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺе°ҶеҜҶе°ҒжңүNO2зҡ„зҺ»з’ғзҗғжөёжіЎеңЁзғӯж°ҙдёӯпјҢж°”дҪ“йўңиүІдјҡеҸҳжө… BпјҺеҗ‘K2CrO4жә¶ж¶ІдёӯеҠ е…ҘзЁҖзЎ«й…ёпјҢжә¶ж¶ІйўңиүІз”ұж©ҷиүІеҸҳдёәй»„иүІ CпјҺеҗ‘зӣӣжңү0.1mol/LMgCl2жә¶ж¶Ізҡ„иҜ•з®ЎдёӯеҠ е…ҘNaOHжә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢеҶҚж»ҙе…Ҙ0.1mol/L FeCl3жә¶ж¶ІпјҢжІүж·ҖжңҖз»ҲеҸҳдёәзәўиӨҗиүІ DпјҺеҗ‘зӣӣжңүNa2CO3жә¶ж¶Ідёӯзҡ„иҜ•з®ЎеҠ е…Ҙй…ҡй…һиҜ•ж¶ІпјҢжә¶ж¶Іе‘ҲзәўиүІпјҢеҶҚеҠ е…Ҙи¶ійҮҸBaCl2жә¶ж¶ІпјҢдә§з”ҹзҷҪиүІжІүж·ҖпјҢжә¶ж¶Ід»Қ然е‘ҲзәўиүІ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
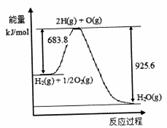
еңЁе…¶д»–жқЎд»¶дёҚеҸҳж—¶пјҢж”№еҸҳжҹҗдёҖжқЎд»¶еҜ№A2(g)+3B2(g)
AпјҺaгҖҒcдёӨзӮ№A2зҡ„иҪ¬еҢ–зҺҮзӣёзӯү BпјҺеҗ‘aзӮ№зҡ„е№іиЎЎдҪ“зі»дёӯеҠ е…ҘA2пјҢеҸҜиҫҫеҲ°bзӮ№зҡ„е№іиЎЎзҠ¶жҖҒ CпјҺbзӮ№ж—¶пјҢе№іиЎЎдҪ“зі»дёӯAгҖҒBеҺҹеӯҗж•°д№ӢжҜ”жңҖжҺҘиҝ‘дәҺ1:3 DпјҺжӯЈеҸҚеә”дёҖе®ҡжҳҜеҗёзғӯеҸҚеә”пјҢдё”T2пјһT1
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯжӯЈзЎ®зҡ„жҳҜ (В В В В ) AпјҺK+зҰ»еӯҗзҡ„з»“жһ„зӨәж„ҸеӣҫВ BпјҺдёүж°ҜеҢ–й“Ғжә¶ж¶ІдёӯеҠ е…Ҙй“ҒзІүзҡ„зҰ»еӯҗж–№зЁӢејҸ CпјҺ8дёӘдёӯеӯҗзҡ„ж°§еҺҹеӯҗзҡ„ж ёзҙ з¬ҰеҸ·В DпјҺж°ҜеҢ–й’ҷзҡ„з”өеӯҗејҸ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ е‘ЁжңҹеҫӢзҡ„е®һиҙЁжҳҜ AпјҺзӣёеҜ№еҺҹеӯҗиҙЁйҮҸйҖҗжёҗеўһеӨ§В В В В В В В В В BпјҺж ёз”өиҚ·ж•°йҖҗжёҗеўһеӨ§ CпјҺж ёеӨ–з”өеӯҗжҺ’еёғе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–В В В В В DпјҺе…ғзҙ еҢ–еҗҲд»·е‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӯ科йҷўеҗҲиӮҘ科еӯҰеІӣзҡ„专家е»әжҲҗвҖңеӨҡеҠҹиғҪй“…й“Ӣе ҶжҠҖжңҜз»јеҗҲе®һйӘҢеӣһи·ҜKYLINвҖ”в…ЎвҖқпјҢиҜҘиЈ…зҪ®жҳҜдё–з•ҢжңҖеӨ§зҡ„еӨҡеҠҹиғҪж¶ІжҖҒй“…й“Ӣз»јеҗҲе®һйӘҢе№іеҸ°пјҢж¶ІжҖҒйҮ‘еұһжқҗж–ҷе…·жңүй«ҳж•ҲеҜјзғӯгҖҒй«ҳжІёзӮ№гҖҒеӨ§е®№йҮҸеӮЁиғҪзҡ„зү№зӮ№пјҢе…·жңүе№ҝжіӣзҡ„еә”з”ЁеүҚжҷҜгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺж¶ІжҖҒйҮ‘еұһй“…дёӯеҗ«жңүзҰ»еӯҗеҒҘВ В В В В В В BпјҺ20.7gй“…дёҺи¶ійҮҸзЁҖзӣҗй…ёеҸҚеә”з”ҹжҲҗ2.24Lж°ўж°” CпјҺеҸҜжә¶жҖ§й“…зӣҗдјҡеј•иө·дёӯжҜ’В В В В В В В В В DпјҺж¶ІжҖҒйҮ‘еұһй“…жҳҜз”ұдәҺе…¶дёӯзҡ„ж°ўй”®дҪңз”ЁиҖҢеҪўжҲҗ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе·ҘеҺӮеәҹж°ҙдёӯеҗ«жёёзҰ»жҖҒж°ҜпјҢйҖҡиҝҮдёӢеҲ—е®һйӘҢжөӢе®ҡе…¶жө“еәҰгҖӮ в‘ еҸ–ж°ҙж ·10.00mLдәҺй”ҘеҪўз“¶дёӯпјҢеҠ е…Ҙ10.00mL KIжә¶ж¶ІпјҲи¶ійҮҸпјүпјҢж»ҙе…ҘжҢҮзӨәеүӮ2пҪһ3ж»ҙгҖӮ в‘ЎеҸ–дёҖеҸӘзўұејҸж»ҙе®ҡз®Ўдҫқж¬Ўз”ЁиҮӘжқҘж°ҙгҖҒи’ёйҰҸж°ҙжҙ—еҮҖпјҢ然еҗҺжіЁе…Ҙ0.01пјҗ molВ·LпјҚ1 Na2S2O3жә¶ж¶ІпјҢи°ғж•ҙж¶ІйқўпјҢи®°дёӢиҜ»ж•°гҖӮ в‘ўе°Ҷй”ҘеҪўз“¶зҪ®дәҺж»ҙе®ҡз®ЎдёӢиҝӣиЎҢж»ҙе®ҡпјҢеҸ‘з”ҹзҡ„еҸҚеә”дёәпјҡI2+2Na2S2O3пјқ2NaI+Na2S4O6гҖӮ иҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүжӯҘйӘӨв‘ еҠ е…Ҙзҡ„жҢҮзӨәеүӮжҳҜ В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүж»ҙе®ҡж—¶пјҢзңјзқӣеә”жіЁи§Ҷ____________________пјҢ еҲӨж–ӯеҲ°иҫҫж»ҙе®ҡз»ҲзӮ№зҡ„зҺ°иұЎжҳҜ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В , иӢҘиҖ—еҺ»Na2S2O3жә¶ж¶І20.00mLпјҢеҲҷеәҹж°ҙдёӯCl2зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә__________________гҖӮ пјҲ3пјүCl2зҡ„е®һйҷ…жө“еәҰжҜ”жүҖжөӢжө“еәҰеә”__________________пјҲвҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңзӣёзӯүвҖқпјүпјҢйҖ жҲҗиҜҜе·®зҡ„еҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮпјҲиӢҘи®ӨдёәжІЎжңүиҜҜе·®пјҢжӯӨй—®дёҚзӯ”пјү
пјҲ4пјүеҸіеӣҫиЎЁзӨә50mLж»ҙе®ҡз®Ўдёӯж¶Ійқўзҡ„дҪҚзҪ®пјҢиӢҘAдёҺCеҲ»еәҰй—ҙзӣёе·®1mLпјҢAеӨ„зҡ„ еҲ»еәҰдёә25пјҢж»ҙе®ҡз®Ўдёӯж¶ІйқўиҜ»ж•°еә”дёәВ В В В В В В В В В В В mLпјҢи®ҫжӯӨж—¶ж¶ІдҪ“дҪ“з§ҜиҜ» ж•°дёәa ml ,ж»ҙе®ҡз®Ўдёӯж¶ІдҪ“зҡ„дҪ“з§Ҝ V пјҲ=гҖҒпјһгҖҒпјңпјүВ В В В В В В пјҲ 50пјҚa пјүmlВ пјҲ5пјүж»ҙе®ҡз»“жқҹж—¶дҝҜи§ҶеҲ»еәҰзәҝиҜ»еҸ–ж»ҙе®ҡз»ҲзӮ№ж—¶Na2S2O3жә¶ж¶Ізҡ„дҪ“з§Ҝ,дјҡеҜјиҮҙжөӢе®ҡз»“жһңВ В В В В В В пјҲвҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңдёҚеҪұе“ҚвҖқпјүгҖӮ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
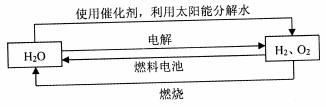
ж°ўж°”жҳҜдёҖз§ҚзҗҶжғізҡ„вҖңз»ҝиүІиғҪжәҗвҖқпјҢдёӢеӣҫдёәж°ўиғҪдә§з”ҹдёҺеҲ©з”Ёзҡ„йҖ”еҫ„
пјҲ1пјүдёҠеӣҫдёӯ4дёӘиҝҮзЁӢдёӯиғҪйҮҸиҪ¬еҢ–еҪўејҸжңү_____________гҖӮ AпјҺ2з§ҚВ BпјҺ3з§ҚВ В В В В CпјҺ4з§ҚВ В В В В DпјҺ4з§Қд»ҘдёҠ пјҲ2пјүз”өи§ЈиҝҮзЁӢиҰҒж¶ҲиҖ—еӨ§йҮҸз”өиғҪпјҢиҖҢдҪҝз”Ёеҫ®з”ҹзү©дҪңеӮ¬еҢ–еүӮеңЁйҳіе…үдёӢеҚіеҸҜеҲҶи§Ј
д»ҘдёҠеҸҚеә”зҡ„в–іH1_____________в–іH2 (йҖүеЎ«вҖң>"гҖҒвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ пјҲ3пјүе·ІзҹҘH2 OпјҲ1пјүвҶ’H2 O(g)в–іH= +44 molВ·L-1пјҢдҫқжҚ®еҸіеӣҫиғҪйҮҸеҸҳеҢ–еҶҷеҮәж°ўж°”зҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙзҡ„зғӯеҢ–еӯҰж–№зЁӢејҸ________________________________гҖӮ пјҲ4пјүж°ўиғҪеҲ©з”ЁйңҖиҰҒйҖүжӢ©еҗҲйҖӮзҡ„еӮЁж°ўжқҗж–ҷ ①镧й•ҚеҗҲйҮ‘еңЁдёҖе®ҡжқЎд»¶дёӢеҸҜеҗёж”¶ж°ўж°”еҪўжҲҗж°ўеҢ–зү©пјҡLaNi5(s)+3H2(g) в‘ЎдёҖе®ҡжқЎд»¶дёӢпјҢеҰӮеӣҫжүҖзӨәиЈ…зҪ®еҸҜе®һзҺ°жңүжңәзү©зҡ„з”өеҢ–еӯҰеӮЁж°ўпјҢжҖ»еҸҚеә”пјҡ2C7 H8+6 H2O(1)
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
дёүз§Қжңүжңәзү©AгҖҒBгҖҒCзҡ„еҲҶеӯҗејҸеқҮдёәC3H6O2пјҢдё”Cдёӯж— з”ІеҹәпјҢжҠҠе®ғ们еҲҶеҲ«иҝӣиЎҢе®һйӘҢпјҢ并记еҪ•зҺ°иұЎеҰӮдёӢпјҡ
пјҲ1пјүз”ұжӯӨжҺЁеҮәAгҖҒBгҖҒCзҡ„з»“жһ„з®ҖејҸдёәпјҡAВ В В В В В В В В В В В В пјҢBВ В В В В В В В В В В В В пјҢCВ В В В В В В В В В В В В пјӣ пјҲ2пјүдёҺAдә’дёәеҗҢеҲҶејӮжһ„дҪ“дё”ж»Ўи¶ід»ҘдёӢжқЎд»¶зҡ„зү©иҙЁзҡ„з»“жһ„з®ҖејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В пјӣ в‘ еҸӘеҗ«жңүдёҖдёӘе®ҳиғҪеӣўВ В В В в‘ЎиғҪеҸ‘з”ҹ银й•ңеҸҚеә” пјҲ3пјүCдёҺ银氨жә¶ж¶ІеҸҚеә”зҡ„ж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|||||||||||||||||||||
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫдёәе®һйӘҢе®ӨеҲ¶еҸ–зәҜеҮҖгҖҒе№ІзҮҘзҡ„Cl2пјҢ并иҝӣиЎҢжЈҖйӘҢCl2жҖ§иҙЁе®һйӘҢзҡ„иЈ…зҪ®гҖӮе…¶дёӯE瓶дёӯж”ҫжңүе№ІзҮҘзәўиүІеёғжқЎпјӣFдёӯдёәй“ңзҪ‘пјҢFеҸіз«ҜеҮәж°”з®ЎеҸЈйҷ„иҝ‘ж”ҫжңүи„ұи„ӮжЈүгҖӮ
иҜ•еӣһзӯ”пјҡ пјҲ1пјүAдёӯжүҖж”ҫиҜ•еүӮдёәВ В В В В В В В В В В В В В В пјҢBдёӯжүҖж”ҫиҜ•еүӮдёәВ В В В В В В В В В В В В В В пјҢдәҢиҖ…еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢ пјҲ2пјүдёәеҫ—еҲ°е№ІзҮҘзәҜеҮҖзҡ„ж°Ҝж°”пјҢдёҖиҲ¬еңЁC瓶дёӯеҠ е…ҘВ В В В В В В В В иҜ•еүӮпјҢD瓶дёӯеҠ е…ҘВ В В В В В В В В иҜ•еүӮгҖӮ пјҲ3пјүE瓶дёӯзҺ°иұЎдёәВ В В В В В В В В В В В В пјӣ FдёӯеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүHдёӯеә”еҠ е…Ҙзҡ„иҜ•еүӮдёәВ В В В В В В В В В В В В В В В В В пјҢе…¶дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ е…¶еҢ–еӯҰж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
зЎ«й…ёй“ңеҸ—зғӯеҲҶи§Јз”ҹжҲҗж°§еҢ–й“ңе’Ңж°”дҪ“пјҢеҠ зғӯжё©еәҰдёҚеҗҢпјҢж°”дҪ“жҲҗеҲҶд№ҹдёҚеҗҢгҖӮж°”дҪ“жҲҗеҲҶеҸҜиғҪеҗ«SO2гҖҒSO3е’ҢO2дёӯзҡ„дёҖз§ҚгҖҒдёӨз§ҚжҲ–дёүз§ҚгҖӮжҹҗеҢ–еӯҰиҜҫеӨ–жҙ»еҠЁе°Ҹз»„йҖҡиҝҮи®ҫи®ЎжҺўз©¶жҖ§е®һйӘҢпјҢжөӢе®ҡеҸҚеә”дә§з”ҹзҡ„SO2гҖҒSO3е’ҢO2зҡ„зү©иҙЁзҡ„йҮҸпјҢ并计算确е®ҡеҗ„зү©иҙЁзҡ„еҢ–еӯҰи®ЎйҮҸж•°пјҢд»ҺиҖҢзЎ®е®ҡCuSO4еҲҶи§Јзҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮе®һйӘҢз”ЁеҲ°зҡ„д»ӘеҷЁеҰӮдёӢеӣҫжүҖзӨәпјҡ
[жҸҗеҮәзҢңжғі] в… .жүҖеҫ—ж°”дҪ“зҡ„жҲҗеҲҶеҸҜиғҪеҸӘеҗ«SO3дёҖз§Қпјӣ в…Ў.жүҖеҫ—ж°”дҪ“зҡ„жҲҗеҲҶеҸҜиғҪеҗ«жңү________дёӨз§Қпјӣ в…ў.жүҖеҫ—ж°”дҪ“зҡ„жҲҗеҲҶеҸҜиғҪеҗ«жңү________дёүз§ҚгҖӮ [е®һйӘҢжҺўз©¶] е®һйӘҢж“ҚдҪңиҝҮзЁӢз•ҘгҖӮе·ІзҹҘе®һйӘҢз»“жқҹж—¶пјҢзЎ«й…ёй“ңе®Ңе…ЁеҲҶи§ЈгҖӮ пјҲ1пјүиҜ·дҪ з»„иЈ…жҺўз©¶е®һйӘҢзҡ„иЈ…зҪ®пјҢжҢүд»Һе·ҰиҮіеҸізҡ„ж–№еҗ‘пјҢеҗ„д»ӘеҷЁжҺҘеҸЈзҡ„иҝһжҺҘйЎәеәҸдёәв‘ вҶ’в‘ЁвҶ’в‘©вҶ’в‘ҘвҶ’в‘ӨвҶ’________вҶ’________вҶ’________вҶ’________вҶ’в‘ЎпјҲеЎ«жҺҘеҸЈеәҸеҸ·пјүгҖӮ пјҲ2пјүиӢҘе®һйӘҢз»“жқҹж—¶BдёӯйҮҸзӯ’жІЎжңү收йӣҶеҲ°ж°ҙпјҢеҲҷиҜҒжҳҺзҢңжғі________жӯЈзЎ®гҖӮ пјҲ3пјүжңүдёӨдёӘе®һйӘҢе°Ҹз»„иҝӣиЎҢиҜҘе®һйӘҢпјҢз”ұдәҺеҠ зғӯж—¶зҡ„жё©еәҰдёҚеҗҢпјҢе®һйӘҢз»“жқҹеҗҺжөӢеҫ—зӣёе…іж•°жҚ®д№ҹдёҚеҗҢпјҢж•°жҚ®еҰӮдёӢпјҡ
иҜ·йҖҡиҝҮи®Ўз®—пјҢжҺЁж–ӯеҮә第дёҖе°Ҹз»„е’Ң第дәҢе°Ҹз»„зҡ„е®һйӘҢжқЎд»¶дёӢCuSO4еҲҶи§Јзҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ 第дёҖе°Ҹз»„пјҡ________________________________________________________пјӣ 第дәҢе°Ҹз»„пјҡ________________________________________________________гҖӮ
|
|||||||||||||
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
з ”з©¶е·Ҙдёҡеәҹејғзү©зҡ„еӨ„зҗҶе’ҢйҳІжІ»е…·жңүйҮҚиҰҒзҡ„ж„Ҹд№үгҖӮ пјҲ1пјүеҲ©з”ЁеҸҚеә”CH4+2NO2 пјҲ2пјүжІ»зҗҶжұҪиҪҰе°ҫж°”дёӯCOе’ҢNOзҡ„дёҖз§Қж–№жі•жҳҜпјҡеңЁжұҪиҪҰжҺ’ж°”з®Ўдёӯе®үиЈ…дёҖдёӘеӮ¬еҢ–иҪ¬еҢ–иЈ…зҪ®пјҢиҜҘиЈ…зҪ®иғҪе°ҶCOе’ҢNOиҪ¬еҢ–дёәеҸӮдёҺеӨ§ж°”еҫӘзҺҜзҡ„ж— жҜ’ж°”дҪ“гҖӮиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә______________. пјҲ3пјүжҹҗж— иүІеәҹж°ҙдёӯеҸҜиғҪеҗ«жңүFe3пјӢгҖҒAl3пјӢгҖҒNaпјӢгҖҒClпјҚгҖҒOHпјҚгҖҒSO42пјҚгҖҒдёӯзҡ„еҮ з§ҚзҰ»еӯҗгҖӮеҲҶеҲ«еҸ–дёүд»Ҫеәҹж°ҙиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ IпјҺиҝӣиЎҢз„°иүІеҸҚеә”е®һйӘҢпјҢзҒ«з„°дёәж— иүІгҖӮ в…ЎпјҺеҸ–100 mLеәҹж°ҙпјҢеҠ е…Ҙи¶ійҮҸзҡ„BaCl2жә¶ж¶ІпјҢз”ҹжҲҗ2.33gзҷҪиүІжІүж·ҖгҖӮ в…ўпјҺеҸ–100 mLеәҹж°ҙпјҢйҖҗж»ҙеҠ е…Ҙ1.0 mol/Lзҡ„NaOHжә¶ж¶ІпјҢж¶ҲиҖ—NaOHжә¶ж¶Ізҡ„дҪ“з§ҜдёҺз”ҹжҲҗжІүж·Җзҡ„иҙЁйҮҸеҰӮдёӢеӣҫжүҖзӨәгҖӮ
иҜ·ж №жҚ®дёҠиҝ°дҝЎжҒҜеӣһзӯ”дёӢеҲ—й—®йўҳпјҡгҖҒ в‘ иҜҘеәҹж°ҙдёӯдёҖе®ҡдёҚеҗ«жңүзҡ„зҰ»еӯҗжҳҜ__________. в‘Ўе®һйӘҢдёӯйңҖй…ҚеҲ¶1.0 mol/Lзҡ„NaOHжә¶ж¶І100 mLпјҢжүҖйңҖд»ӘеҷЁйҷӨдәҶзҺ»з’ғжЈ’гҖҒжүҳзӣҳеӨ©е№ігҖҒйҮҸзӯ’гҖҒиҚҜеҢҷгҖҒзғ§жқҜгҖҒиғ¶еӨҙж»ҙз®ЎпјҢиҝҳзјәе°‘зҡ„д»ӘеҷЁжңү_______гҖӮ в‘ўеҶҷеҮәеӣҫдёӯAвҶ’BеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ_________________гҖӮ в‘ЈйҖҡиҝҮи®Ўз®—пјҢиҜҘеәҹж°ҙдёӯ______ClпјҚпјҲеЎ«вҖңеҗ«жңүвҖқжҲ–вҖңдёҚеҗ«жңүвҖқпјүпјӣиӢҘеҗ«жңүпјҢеҲҷcпјҲClпјҚпјү=________пјҲиӢҘдёҚеҗ«жңүпјҢжӯӨй—®дёҚеҝ…дҪңзӯ”пјүгҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүеҰӮдёӢеҢ–еӯҰеҸҚеә”пјҡ2AпјҲgпјүпјӢBпјҲgпјү пјҲ1пјүиӢҘжҠҠamolAе’ҢbmolBе……е…ҘдёҖеҜҶй—ӯе®№еҷЁдёӯпјҢиҫҫеҲ°е№іиЎЎж—¶е®ғ们зҡ„зү©иҙЁзҡ„йҮҸж»Ўи¶іпјҡ nпјҲAпјүпјӢnпјҲBпјү=nпјҲCпјүпјҢжұӮAзҡ„иҪ¬еҢ–зҺҮпјӣ пјҲ2пјүиӢҘе°Ҷ4molAе’Ң2molBеҠ е…ҘдҪ“з§ҜеҸҜеҸҳзҡ„зӯүеҺӢе®№еҷЁдёӯпјҢдёҖе®ҡжё©еәҰдёӢиҫҫеҲ°е№іиЎЎзҠ¶жҖҒпјҢжөӢеҫ—ж°”дҪ“жҖ»зү©иҙЁзҡ„йҮҸдёә4пјҺ2molгҖӮжӯӨж—¶пјҢжұӮж··еҗҲж°”дҪ“дёӯCзҡ„дҪ“з§ҜеҲҶж•°гҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
GжҳҜдёҖз§Қеёёи§Ғзҡ„ж°Ёеҹәй…ёпјҢе…¶еҗҲжҲҗи·ҜзәҝеҰӮдёӢпјҡ
В е·ІзҹҘд»ҘдёӢдҝЎжҒҜпјҡ в‘ AиӢҜзҺҜдёҠеҸӘжңү1дёӘеҸ–д»Јеҹәдё”ж ёзЈҒе…ұжҢҜж°ўи°ұжңү6з»„еі°пјҢе…¶йқўз§ҜжҜ”дёә1пјҡ2пјҡ2пјҡ2пјҡ2пјҡ1пјӣDе’ҢFзҡ„иӢҜзҺҜдёҠзҡ„дёҖж°Ҝд»Јзү©йғҪеҸӘжңү2з§ҚпјҺ в‘ЎFгҖҒGиғҪдёҺFeCl3жә¶ж¶ІеҸ‘з”ҹжҳҫиүІеҸҚеә”пјҢFиғҪеҸ‘з”ҹ银й•ңеҸҚеә” в‘ў еӣһзӯ”дёӢеҲ—й—®йўҳ пјҲ1пјүAзҡ„еҲҶеӯҗејҸдёә__________пјҢе…¶еҗҚз§°дёә __________гҖӮ пјҲ2пјүAвҶ’Bзҡ„еҸҚеә”зұ»еһӢжҳҜ__________пјӣйүҙеҲ«Aе’ҢBеҸҜз”Ёзҡ„иҜ•еүӮжҳҜ__________гҖӮ пјҲ3пјүBвҶ’Cзҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________гҖӮ пјҲ4пјүGзҡ„з»“жһ„з®ҖејҸдёә__________гҖӮ пјҲ5пјүFзҡ„еҗҢеҲҶејӮжһ„жһ„дҪ“пјҢеҗ«жңүиӢҜзҺҜдё”иғҪеҸ‘з”ҹж°ҙи§ЈеҸҚеә”зҡ„ејӮжһ„дҪ“жңү__________з§ҚпјҢе…¶дёӯж ёзЈҒе…ұжҢҜж°ўи°ұжңү4з»„еі°пјҢдё”йқўз§ҜжҜ”дёә3пјҡ2пјҡ2пјҡ1зҡ„жҳҜ__________гҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
иҠійҰҷзғғAжҳҜдёҖз§ҚйҮҚиҰҒзҡ„жңүжңәеҢ–е·ҘеҺҹж–ҷпјҢд»ҘAдёәеҺҹж–ҷеҲ¶еӨҮиҚҜе“Ғж¶ҲзӮҺзҒө(зӣҗй…ёзҘӣзӮҺз—ӣ)зҡ„дёӯй—ҙдә§зү©Fзҡ„иҪ¬еҢ–и·Ҝзәҝдёәпјҡ
(1)Eдёӯеҗ«ж°§е®ҳиғҪеӣўзҡ„еҗҚз§°жҳҜ__________гҖӮCвҶ’Eзҡ„жңүжңәеҸҚеә”зұ»еһӢжҳҜ_______________гҖӮ (2)еҶҷеҮәAвҶ’Bзҡ„еҢ–еӯҰж–№зЁӢејҸ__________________________________________________гҖӮ (3)EеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜиҒҡеҗҲз”ҹжҲҗзғӯеӣәжҖ§еҫҲеҘҪзҡ„еҠҹиғҪй«ҳеҲҶеӯҗGпјҢиҜ•еҶҷеҮәGзҡ„з»“жһ„з®ҖејҸ__________________гҖӮ (4)дёҠиҝ°AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFе…ӯз§Қжңүжңәзү©дёӯдә’дёәеҗҢеҲҶејӮжһ„дҪ“зҡ„жҳҜ(з”Ёеӯ—жҜҚд»ЈеҸ·иЎЁзӨә)____________________гҖӮ
|
|
- иҘҝи—ҸиҮӘжІ»еҢәжӢүиҗЁдёӯеӯҰ2020еұҠй«ҳдёүеүҚеҚҠжңҹ第еӣӣж¬ЎжңҲиҖғзҗҶз»јеҢ–еӯҰ
- 2019еұҠй«ҳдёүдёӢеҚҠжңҹ4жңҲ第дәҢж¬ЎжЁЎжӢҹиҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰиҖғиҜ•пјҲж№–еҚ—зңҒжҖҖеҢ–еёӮпјү
- жө·еҚ—еҚҺдҫЁдёӯеӯҰи§Ӯжҫңж№–еӯҰж Ў2020еұҠй«ҳдёүдёҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·еңЁзәҝжЈҖжөӢ
- еҗүжһ—2019е№ҙй«ҳдёҖеҢ–еӯҰеҗҺеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ
- й«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№ пјҲ2018-2019е№ҙе№ҝиҘҝе…ҙе®үеҺҝ第дёүдёӯеӯҰпјү
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•жЁЎжӢҹиҖғиҜ•и®ӯз»ғ
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖдёҠеҶҢ10жңҲжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲеұұиҘҝзңҒеҝ»е·һеёӮ第дәҢдёӯеӯҰпјү
- жұҹиӢҸзңҒжү¬е·һеёӮ2021еұҠй«ҳдёүдёҠеӯҰжңҹжЈҖжөӢеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ