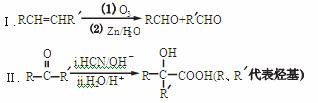2016江苏高三下学期苏教版高中化学月考试卷
| 1. | 详细信息 |
|
下列说法正确的是 A.钠原子与氯气分子反应生成氯化钠后,其结构的稳定性增强 B.选择燃料只要考虑燃料燃烧值的大小 C.失电子难的原子获得电子的能力一定强 D.两个原子之间的相互作用叫化学键
|
|
| 2. | 详细信息 |
|
下列说法正确的是( ) A.海水中含量最高的元素是氯 B.海水中含量最高的物质是氯化钠 C.加碘食盐溶液遇淀粉溶液显蓝色 D.加碘食盐中的碘是含碘元素的化合物
|
|
| 3. | 详细信息 |
|
下列物质中,不属于电解质的是 A.Cu B.
|
|
| 4. | 详细信息 |
|
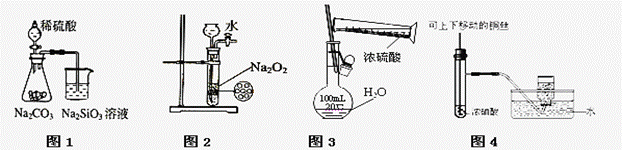
下列图示实验合理的是
A.图1为证明非金属性强弱: B.图2为制备少量氧气 C.图3为配制一定物质的量浓度的硫酸溶液 D.图4为制备并收集少量NO2
|
|
| 5. | 详细信息 |
|
P轨道电子云形状正确的是 A.球形对称 B.圆形对称 C.极大值在x、y、z轴上的纺锤形 D.互相垂直的花瓣形
|
|
| 6. | 详细信息 |
|
下列过程中肯定不可逆的是 A.蛋白质的盐析 B.蛋白质的变性 C.乙酸乙酯的水解 D.CO2与水的反应
|
|
| 7. | 详细信息 |
|
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃 料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,关于该电池描述正确的是
A.电池工作时H+移向负极 B.该装置还可以将电能转化成为化学能 C.理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 D.电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+
|
|
| 8. | 详细信息 |
|
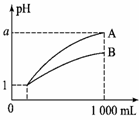
pH=1的两种酸溶液A、B各1 mL
①若a<4,则A、B都是弱酸 ②稀释后,A酸溶液的酸性比B酸溶液强 ③若a=4,则A是强酸,B是弱酸 ④A、B两种酸溶液的物质的量浓度一定相等 A.①④ B.②③ C.①③ D.②④
|
|
| 9. | 详细信息 |
|
0.1 mol有机物的蒸气跟过量O2混合后点燃,生成13.2 g CO2和5.4 g H2O,该有机物跟金属钠 反应放出H2;又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物。该酯类化合物的结构简式可能是( ) A.CH3CH(OCH3)CHO B.OHCCH2COOCH2CH3 C.CH3COOCH(CH3)CHO D.CH3COOCH2CH2COCH3
|
|
| 10. | 详细信息 |
|
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) A.v正、v逆都减小,平衡逆向移动 B.v正、v逆都增大,平衡正向移动 C. v逆增大,v正减小,平衡逆向移动 D.v逆减小,v正增大,平衡正向移动
|
|
| 11. | 详细信息 |
|
下列各组物质的晶体中化学键类型相同,晶体类型也相同的是 A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.NaOH和CCl4
|
|
| 12. | 详细信息 |
|
已知一定条件下:A2B5(g) A.0.1mol/L B. 0.2mol/L C.0.9mol/L D.1.5 mol/L
|
|
| 13. | 详细信息 |
|
某烃的衍生物A,分子式为C6H12O2。实验表明A跟氢氧化钠溶液共热生成B和C,B跟盐酸反应生成有机物D,C在铜催化和加热条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能结构有 A.6种 B.4种 C.3种 D.2种
|
|
| 14. | 详细信息 |
|
下列离子方程式中,正确的是高 A.水玻璃中通入足量的CO2: B.氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2==2Fe3++2Cl- C.NaHCO3溶液中加入足量NaHSO4溶液: 2H++CO D.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH =CaCO3↓+H2O
|
|
| 15. | 详细信息 | ||||||||||||
|
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)
以下对反应过程的分析和判断正确的是 A. 反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1 B.保持其他条件不变,若升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应为放热反应 C. 相同温度下,若起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,则达平衡前v(正)>v(逆) D.相同温度下,若起始时向容器中充入2.0molPCl3、2.0molCl2,则达平衡时,PCl3的转化率大于80%
|
|||||||||||||
| 16. | 详细信息 |
|
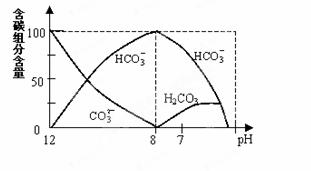
在含有弱电解质的溶液中,往往有多个化学平衡共存。 (1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____ A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)] (2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题: ①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。 ②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是: 。 ③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
|
|
| 17. | 详细信息 |
|
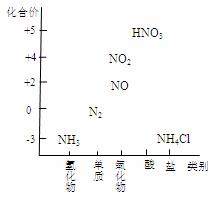
下图为氮及其化合物的类别与化合价对应的关系图。
(1)实验室制取氨气。 ① 化学方程式是 。 ② 可用向下排空气法收集氨气的原因是 。 ③ 用水吸收多余的氨气时,如将导管直接插入水中, 会产生倒吸现象,产生该现象的原因是 。 (2)完成下列能生成NO的化学方程式: ① 体现N元素的还原性: a. 汽车尾气中产生的NO:N2 + O2 b. 氨的催化氧化:_________。 ② 体现N元素的氧化性:_________。 (3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
① NO2溶于水的化学方程式是_________。 ② 使试管中NO2完全被水吸收的操作是________。
|
|
| 18. | 详细信息 |
|
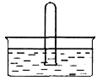
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)请写出乙醇催化氧化的化学方程式 。 在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是 反应(填“吸热”或“放热”)。 (2)甲和乙两个水浴作用不相同。 甲中盛 (填“热水”或“冷水”)作用是 ;乙中盛 (填“热水”或“冷水”)作用是 。 (3)丙中集气瓶内收集到的气体的主要成分是 。 (4)如何要检验试管a中收集到的反应生成物 。
|
|
| 19. | 详细信息 |
|
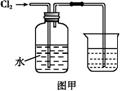
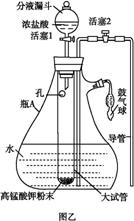
氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。
(1)氯水需临时配制的原因是 (用化学方程式表示)。 (2)图甲所示装置中,烧杯内的液体是 。 (3)用图乙所示装置中配制氯水时,操作步骤如下: ①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。 ②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。 ③轻轻摇动瓶A ,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。 分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。 (4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是 。
|
|
| 20. | 详细信息 |
|
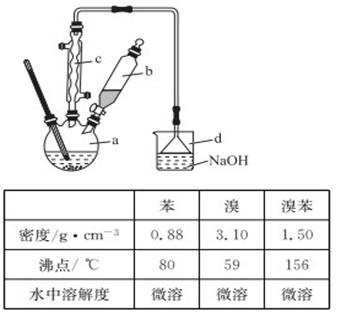
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题: (1)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体,继续滴加液溴滴完。装置d的作用是______________________; (2)液溴滴完后,经过下列步骤分离提纯: ①向a中加入10 mL水,然后过滤除去未反应的铁屑; ②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________; ③向分出的粗苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______________; (3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母); A.重结晶 B.过滤 C.蒸馏 D.萃取 (4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。 A.25 mL B.50 mL C.250 mL D.500 mL
|
|
| 21. | 详细信息 |
|
将19.2g铜加入到足量的稀硝酸溶液中,反应完全,反应后溶液的体积为500mL。计算: ⑴产生的气体在标准状况下的体积; ⑵反应后溶液中Cu2+的物质的量浓度。
|
|
| 22. | 详细信息 |
|
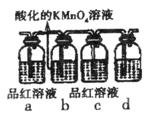
掌握物质之间的转化,是学习元素化合物知识的基础。 (I)(1)中学常见的某反应的化学方程式为: A+B→C+D+H2O(未配平,反应条件略去)。 若C、D均为气体,且都能使澄清石灰水变浑浊。 ①请写出该反应的化学方程式____________; ②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则b瓶溶液的作用是_________,该溶液还可以用_____________试剂代替。
③装置d中所盛溶液是__________。 (II)下列框图所示的物质转化关系中,甲、乙、丙是常见的气体单质。气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去)。
请回答下列问题: (1)写出C的电子式:___________________________。 (2)E是_______化合物(填“共价”或“离子”,含有的化学键为__________________。 (3)写出B和丙生成A的离子反应方程式_________________________________________。 (4)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式: ______________________________________________________________________。
|
|
| 23. | 详细信息 |
|
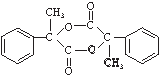
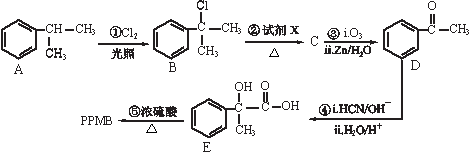
PPMB(
已知: (1)试剂X为____________________;E中含氧官能团名称为__________。 (2)遇氯化铁溶液显紫色且苯环上有两个取代基的D的同分异构体有________种。 (3)E在一定条件下可以生成高聚物F,F的结构简式为___________。 (4)PPMB与足量氢氧化钠的水溶液共热的化学方程式为__________________。
|
|
| 24. | 详细信息 |
|
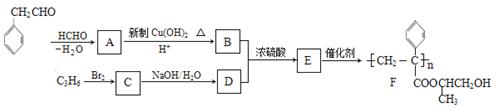
下列为合成聚合物F的路线图:
请根据以上信息,回答下列问题: (1)A中含有官能团(不考虑苯环,下同)名称是_________,C的系统命名为_________。 (2) B+D→E的反应类型是__________,检验B中所含官能团所用的试剂有_______。 (3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为_______________。 (4)G物质的相对分子质量比 ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
|
|