桐乡市高二化学上册期末考试摸底考试题
| 1. 选择题 | 详细信息 |
|
下列有关说法正确的是 A.催化剂通过降低化学反应的焓变加快化学反应速率 B.化学反应中的焓变为负,反应放热;焓变为正,反应吸热 C.温度保持不变.向水中加入钠盐对水的电离一定没有影响 D.向醋酸钠溶液中加水稀释时.溶液中所有离子浓度都减小 |
|
| 2. 选择题 | 详细信息 |
|
下列关于能量变化的说法,正确的是 A.将等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同 B.2Na+ 2H2O= 2NaOH+H2↑ 该反应生成物的总能量高于反应物的总能量 C.放热反应中,反应物的总能量大于生成物的总能量 D.化学键的断裂是吸热过程,并且一定发生了化学变化 |
|
| 3. 选择题 | 详细信息 |
|
1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为( ) A. 40 g B. 56 g C. 60 g D. 64 g |
|
| 4. 选择题 | 详细信息 |
下列装置或操作能达到实验目的的是( )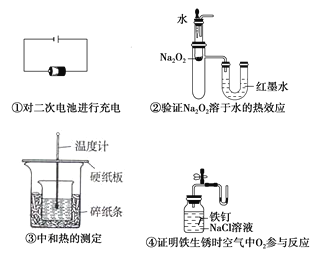 A. ②④ B. ①②③ C. ①②④ D. ①②③④ |
|
| 5. 选择题 | 详细信息 |
|
下列关于热化学反应的描述中正确的是( ) A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则1 mol硫酸与足量氢氧化钡溶液反应放热为114.6 kJ B. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(1)=2H2(g)+O2(g)反应的△H=+571.6kJ·mol-1 C. 反应物的热效应与是否使用催化剂有关 D. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g) + 3H2(g) ⇌ 2NH3(g) △H= -38.6 kJ·mol-1 |
|
| 6. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 需要加热的反应一定是吸热反应 B. 放热反应X(s)=Y(s),则X比Y稳定 C. 硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 D. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
|
| 7. 选择题 | 详细信息 |
|
下列变化过程,属于放热反应的是:①水蒸气变成液态水 ②酸碱中和反应 ③浓H2SO4 稀释 ④固体NaOH溶于水 ⑤ H2 在 Cl2 中燃烧 ⑥食物腐败 A.②⑤⑥ B.②③④ C.①③⑤ D.全部 |
|
| 8. 选择题 | 详细信息 |
|
下列转化必须要通过加氧化剂才能发生的是 A. NaHCO3→Na2CO3 B. KClO3→O2 C. KI→I2 D. Cl2→HClO |
|
| 9. 选择题 | 详细信息 |
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,两个常见的固氮反应的平衡常数的对数值(lgK)与温度的关系如图所示:①N2+3H2⇌2NH3 ②N2+O2⇌2NO;根据图中的数据判断下列说法正确的是( ) A.反应①和②均为放热反应 B.升高温度,反应①的反应速率减小 C.在1000℃时,反应①和反应②体系中N2的浓度一定相等 D.在标准状况下,利用反应①固氮和利用反应②固氮反应程度相差很大 |
|
| 10. 选择题 | 详细信息 |
|
下列关于电解的说法正确的是 A.工业上通常用电解饱和食盐水生产金属钠,电解熔融氯化铝冶炼铝 B.电镀时,通常把待镀的金属制品做阳极 C.电解法精炼铜时,其含有的Zn、Fe、Ni、Ag、Au等杂质沉积在电解槽的底部 D.二次电池充电过程的实质是电解,充电时应将其负极与充电器电源的负极相连 |
|
| 11. 选择题 | 详细信息 |
已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l 氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )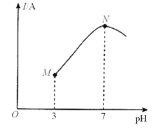 A.M点→N点,水的电离程度逐渐增大 B.25℃时,CH3COOH 的电离常数约为1.0×10-2 C.N点溶液中,c(CH3COO-)>c(NH4+) D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+) |
|
| 12. 选择题 | 详细信息 |
炔烃的偶联反应在开发新型发光材料、超分子等领域有重要研究价值。乙炔发生的偶联反应为 2CH≡CH 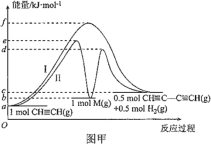 A.曲线Ⅰ,反应物的总键能大于生成物的总键能 B.曲线Ⅱ改变的条件是加入了催化剂 C.曲线Ⅱ对应条件下,第一步反应的 ΔH=+(b-a)kJ·mol-1 D.曲线Ⅱ对应条件下,决定总反应速率的大小是第二步反应 |
|
| 13. 选择题 | 详细信息 |
如图装置,放电时可将 Li、CO2 转化为 Li2CO3 和 C,充电时选用合适催化剂仅使Li2CO3 转化为Li、CO2 和O2。下列有关表述正确的是( ) A.放电时,Li+向电极X 方向移动 B.放电时,每转移 4mol 电子,生成 1mol C C.充电时,电极Y 应与外接直流电源的负极相连 D.充电时阳极的电极反应式为 C+2Li2CO3+4e- = 3CO2+4Li+ |
|
| 14. 选择题 | 详细信息 |
|
①分别取1mL0.0lmol/LFeCl3和0.01mol/LKSCN混合液两份;②向第一份中滴加3滴饱和FeCl3溶液,溶液颜色加深;③再向上述溶液中滴加3滴1mol・L-1NaOH溶液,溶液颜色变浅且出现浑浊:④向第二份中逐渐滴加1mol・L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析错误的是( ) A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-=Fe(SCN)3正向移动 B.实验③中发生反应:Fe3++3OH-=Fe(OH)3↓ C.实验③和④中溶液颜色变浅的原因相同 D.实验②、③、④均可说明浓度改变对平衡移动的影响 |
|
| 15. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A.硫酸镁溶液与氨水反应 Mg2++2OH-=Mg(OH)2↓ B.碳酸氢铵溶液中加过量的 NaOH 溶液HCO3-+OH-=CO32-+H2O C.酸性高锰酸钾溶液中滴加双氧水产生气泡 2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑ D.等物质的量的Cl2 和 FeBr2 在溶液中反应 2Br-+Cl2=2Cl-+Br2 |
|
| 16. 选择题 | 详细信息 |
|
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( ) A.常温下,中性溶液中, B.向含有 C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3- D.向 |
|
| 17. 选择题 | 详细信息 |
|
常温下,下列各离子能在指定溶液中一定大量共存的是( ) A.使甲基橙变红的溶液:Fe2+、NO3-、SO42-、Na+ B.加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3- C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ D. |
|
| 18. 选择题 | 详细信息 |
|
下列关于某0.1mol·L-1的CH3COOH溶液的说法,正确的是 A.在溶液中增加水的量,CH3COOH的电离平衡右移,平衡常数K增大 B.加入NaOH固体到溶液呈碱性,则整个过程溶液中水的电离程度一直增大 C.加入少量的NaOH固体,使溶液中的c(Na+)=c(CH3COO-),则溶液一定呈中性 D.加入少量的NaOH固体,使溶液的pH=7,则溶液一定呈中性 |
|
| 19. 选择题 | 详细信息 |
|
某溶液改变一个条件,酸性一定增大的是 A.酸雨在空气中放置一段时间 B.使溶液中c(H+)增大 C.使溶液中c(OH-)减小 D.稀盐酸露置于空气中 |
|
| 20. 选择题 | 详细信息 |
|
某同学为测定HCl的浓度,取20.00mL该HCl于锥形瓶内,用0.1mol·L-1的NaOH溶液来滴定,20.00mL关于中和滴定的说法,下列正确的是 A.在锥形瓶中加入少量水,测得的HCl溶液的浓度会偏小 B.在锥形瓶中加入2到3mL的酚酞作指示剂 C.在滴定过程中,眼睛注视滴定管中液面的变化 D.滴定前平视,滴定结束后俯视滴定管读数,测得的HCl溶液的浓度的会偏低 |
|
| 21. 选择题 | 详细信息 |
某温度下,等体积、PH相同的盐酸和醋酸溶液分别加水稀释,溶液中的随溶液体积变化的曲线如图所示。据图判断下列说法正确的是 A.b点酸的总浓度大于a点酸的总浓度 B.b点溶液的导电性比c点溶液的导电性弱 C.取等体积的a点、b点对应的溶液,消耗的NaOH的量相同 D.曲线Ⅰ表示的是盐酸的变化曲线 |
|
| 22. 选择题 | 详细信息 |
|
有两种一元弱酸的钠盐溶液,其物质的量浓度相等,向这两种盐溶液中分别通入适量的二氧化碳,发生如下反应:NaR1+CO2+H2O = HR1+NaHCO3 2NaR2+CO2+H2O = 2HR2+Na2CO3。 HR1和HR2的酸性强弱比较,正确的是 A.HR1较弱 B.HR2较弱 C.二者相同 D.无法比较 |
|
| 23. 选择题 | 详细信息 |
|
在下列各溶液中各离子的浓度由大到小排列顺序正确的是 A.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) B.Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) C.CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.NaHSO3溶液中:c(Na+)﹥c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
|
| 24. 选择题 | 详细信息 |
某温度下,弱酸H2A溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ[δ(X)=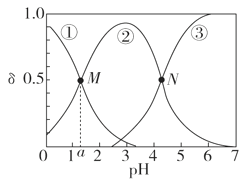 A.pH>4的溶液中,δ(A2-)= 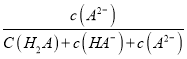 , ,B.M点对应的溶液中水的电离程度小于N点 C.若图中a为1.2,则lg [Ka1(H2A)]=-1.2 D.曲线②代表的粒子是HA- |
|
| 25. 选择题 | 详细信息 |
|
取某固体样品,进行如下实验 ①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣; ②取少量滤液,加入BaCl2溶液,有白色沉淀产生; ③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。 根据上述实验现象,该固体样品的成分可能是 A. K2SO4、Ba(OH)2、Na2CO3 B. Na2CO3、AgNO3、KNO3 C. K2CO3、NaCl、Ba(NO3)2 D. KNO3、MgCl2、NaOH |
|
| 26. 解答题 | 详细信息 |
|
按要求填空 (1)NH4Cl溶液呈酸性,用离子方程式表示其原因___________________________________; (2)25℃时1g甲烷完全燃烧生成二氧化碳气体和液态水,放出56千焦的热量,写出该反应的热化学方程式:_____________________________ ; (3)铁在空气中发生吸氧腐蚀时的正极反应方程式:_________________________________ (4)硫酸铜溶液通电时发生的化学反应方程式:_______________________________ |
|
| 27. 填空题 | 详细信息 |
|
已知重铬酸根(Cr2O72-)和铬酸根(CrO42-)离子间存在如下平衡:Cr2O72- +H2O |
|
| 28. 推断题 | 详细信息 |
有关物质存在如图所示的转化关系,已知C、G、H为中学常见的单质,其中G 固态时呈紫黑色,C、H在通常状况下为气体,实验室常用E在B的催化加热下制单质H。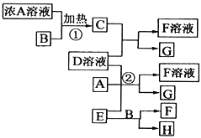 (1)写出B物质的名称 _______________________ ; (2)写出①的化学反应方程式 ___________________________________________________ ; (3)写出②的离子方程式_____________________________________________________________; (4)在D溶液中通入C 后的溶液中,分离出G 的操作名称是_______________________。 |
|
| 29. 解答题 | 详细信息 |
在一密闭容器中发生反应N2+3H2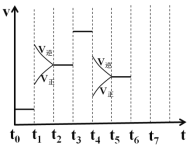 (1)处于平衡状态的时间段是______(填选项); A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6 (2)t1、t3、t4时刻分别改变的一个条件是(填选项); A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F充入氮气 t1时刻__________;t4时刻__________; (3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________(填选项); A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6 (4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线_________; (5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为____________________。 |
|
| 30. 综合题 | 详细信息 |
|
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种 ①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+) ③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-) (1)上述关系一定不正确的是_______________(填序号); (2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号); (3)若关系③正确,则溶液中溶质为_________; (4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。 (5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。 |
|
| 31. 计算题 | 详细信息 |
| 称取10g含杂质的Na2CO3样品(杂质不参与反应),加入100 mL(设密度为1.0g·mL-1)稀盐酸,充分反应后烧杯中剩余物质的总质量为106.48g(生成的气体全部逸出),碳酸钠样品的纯度为 _______________________。若将反应后的溶液加水稀释到400mL,测得溶液的pH为1,则原稀盐酸的物质的量浓度为 _________________ mol·L-1。 | |
最近更新



